Síntesis
de Isoquinoleinas
(Por
el método de las desconexiones)
|
|
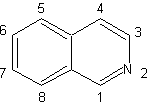
Las
isoquinoleinas difieren estructuralmente de las quinoleinas en la
posición del nitrógeno, ya que esta
última, no se encuentra fusionada, por lo que presenta una “reactividad
alifática”.
No se encuentra libre en la
naturaleza, pero el ciclo de la isoquinoleina se encuentra en algunos
alcaloides, en forma aromática o reducida, por ejemplo, la papaverina. |
Los métodos sintéticos más conocidos para la preparación de isoquinoleinas
se inician con 2-feniletilaminas y comprenden una ciclación por intermedio de
un carbono adicional proporcionado por el grupo carbonilo de otro compuesto.
Los principales métodos sintéticos son: La síntesis de Pomeranz-Fritsch, la
síntesis de Bischler-Napieralski, síntesis de Pictet-Gams y la síntesis de
Pictet-Spengler.
1. Síntesis
de POMERANZ-FRITSCH.
Este método de
síntesis de la isoquinoleina, se produce en dos etapas:
a.
En primer lugar, se condensa el benzaldehído
(1,3-electrófilo-nucleófilo) con el dietilacetal del aminoacetaldehido
(1,3-nucleófilo-electrófilo) para formar una aldimina estable.
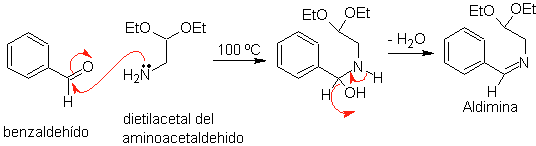
b.
Seguidamente, la aldimina cicla en un medio ácido fuerte,
a una imina, con eliminación simultánea de etanol, para producir una
isoquinoleina.
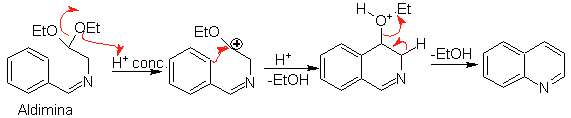
Esta segunda etapa, al ser una sustitución electrofílica, está sujeta al
efecto que tienen en dicha reacción los sustituyentes aceptores o donadores de
electrones sobre el anillo bencénico. Sin embargo, debido a la hidrólisis de la
imina formada, en el medio ácido fuerte utilizado en la reacción, reduce el
rendimiento del proceso.
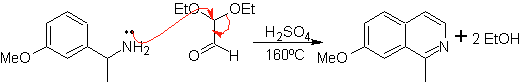
Este método, permite acceder a isoquinoleinas sustituidas en el C-1, para
lo cual se han probado cetonas aromáticas, con rendimientos muy bajos. No
obstante, se ha tenido mayor éxito al utilizar la variante de las bencilaminas
adecuadamente sustituidas como 1,4-dinucleófilos y el dietilacetal del glioxal
como 1,2-dielectrólfilos
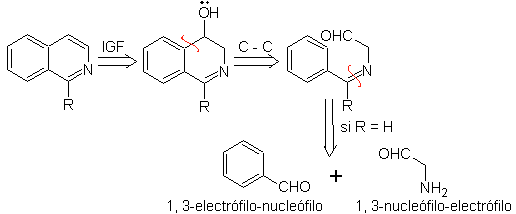
Algo que debe quedar en claro, es que el método de Pomeranz-Fritsch y su
variante, anteriormente analizada, no permiten preparar isoquinoleinas
sustituidas en el C-3 y el C-4 del heteroátomo. El análisis retrosintético de
este método, muestra los posibles intermediarios implicados en la reacción y
los materiales probables de partida.
|
Proponer un
diseño de síntesis, para cada una de las siguientes isoquinoleinas:
|
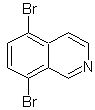
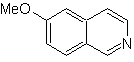
MOb
107
|
|
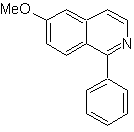
MOb 108
|
MOb 107. Análisis retrosintético. La
desconexión de
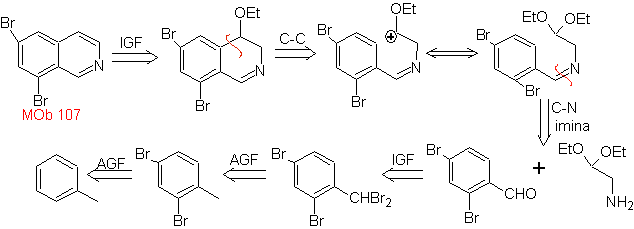
MOb 108. Análisis retrosintético. La presencia
de un sustituyente en el C1 de la isoquinoleina, conduce a desconectar
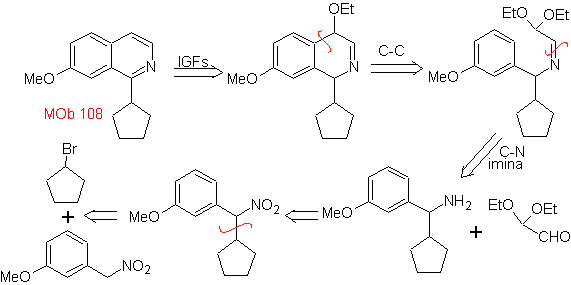
Síntesis
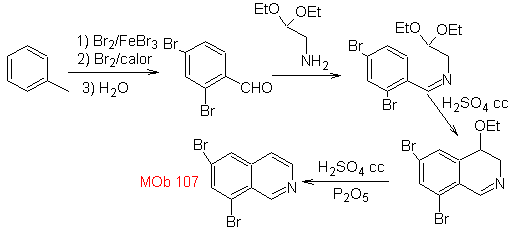
Se prepara el derivado de la bencialmina, para hacer reacciona con el diacetal
del aminoaldehído, según la síntesis de Pomeranz-Fritsch, para formar
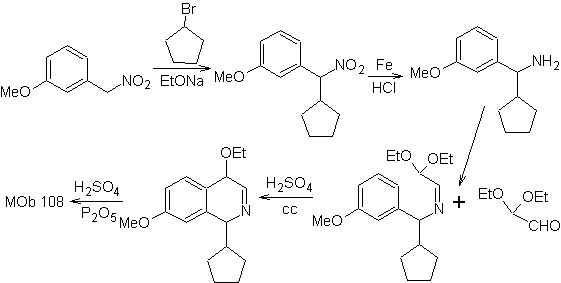
2. Síntesis
de BISCHLER-NAPIERALSKI[1].
Este método sintético de las isoquinoleinas, implica la reacción de una
Fenetilamina (1,5-dinucleófilo) con un cloruro o anhídrido de ácido
(electrófilo) para formar una amida, cuya ciclación con pérdida de agua conduce
a una 2,4-dihidroisoquinoleina con un sustituyente en el C-1, que se oxida a
isoquinoleina con Pd-C o disulfuro de fenilo.
El paso de ciclación es una sustitución electrofílica aromática y por tanto
se verá favorecida por sustituyentes electrodonadores en el anillo aromático de
la fenetilamina. Las fenetilaminas m-sustituidas conducen exclusivamente a
isoquinoleinas sustituidas en el C-6, debido a la ciclación en la posición para
respecto del grupo activante.
El análisis
retrosintético de las isoquinoleinas que se preparan por este método es como
sigue:
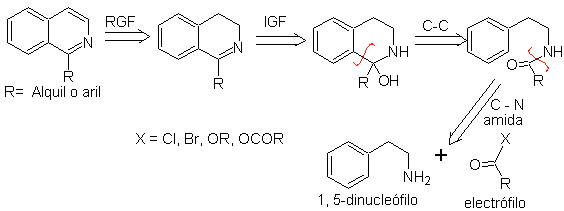
Los agentes de ciclación que con mayor frecuencia se utilizan en esta
síntesis, son:
a.
P2O5 (pentóxido de fósforo)
b.
POCl3 (oxicloruro de fósforo) y
c.
SOCl2 (cloruro de tionilo)
|
Proponer un
plan de síntesis para las siguientes isoquinoleinas:
|
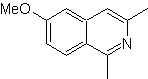
MOb
109
|
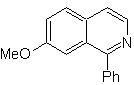
|
MOb
110
|
MOb
109. Análisis
retrosintético.
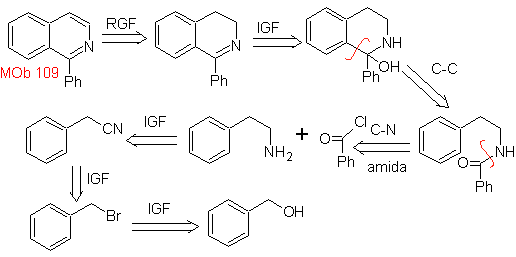
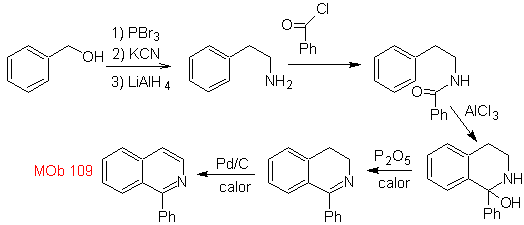
Síntesis. El alcohol
bencílico, es un buen material de partida para formar la fenetilamina, que se
combina con el cloruro de benzoilo. El producto se cicla y aromatiza con Pd/C y
calor para formar
MOb 110. Análisis retrosintético.
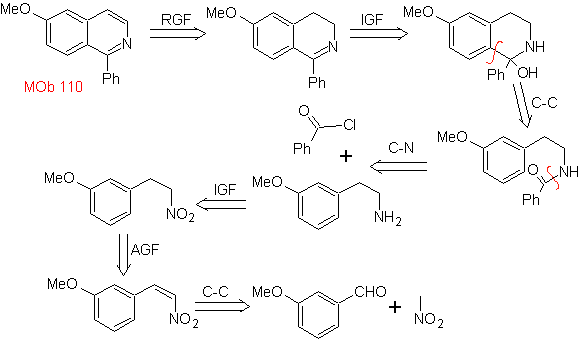
Síntesis. La síntesis de
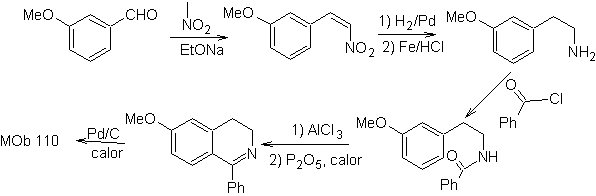
3.
Síntesis
de PICTET – GAMS.
Es una variante de la síntesis de Bischler-Napieralski, en este método se
utilizan Fenetilaminas potencialmente insaturadas, obteniéndose un heterociclo
totalmente aromático, no siendo por lo tanto necesaria la aplicación de
oxidantes.
El análisis retrosintético de este método, muestra las siguientes
reconexiones y materiales de partida potenciales.
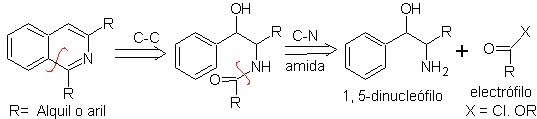
|
Proponer un
diseño de síntesis para la siguiente isoquinoleina:
|
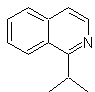
MOb
111.
|
MOb
111.
Análisis retrosintético. Para iniciar la desconexión de
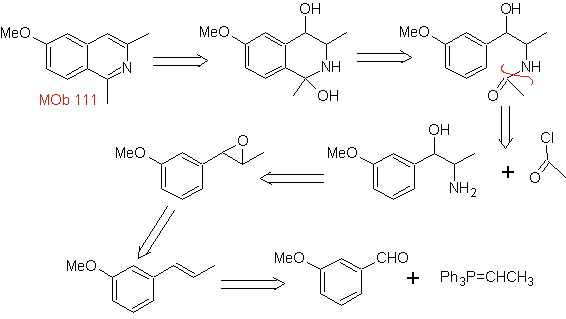
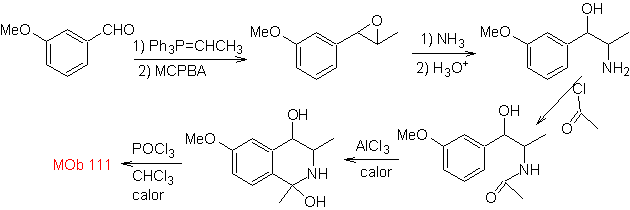
Síntesis. Se aplica la
síntesis de Pictet-Gams, por lo que no es necesario utilizar un oxidante al
final, para llegar a la formación de
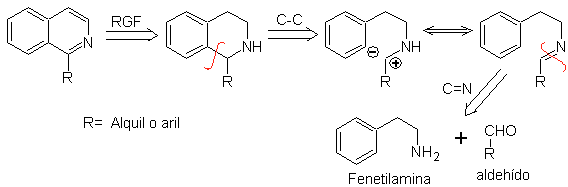
Las Fenetilaminas también pueden reaccionar con aldehídos con buenos
rendimientos, dando aldiminas que puede ciclar en medio ácido a
1,2,3,4-tetrahidroisoquinoleinas, que deben ser oxidadas para producir
isoquinoleinas.
Esta ciclación precisa de sustituyentes activantes colocados adecuadamente,
para activar las posiciones orto al grupo aminoetilo, razón por la cual el
cierre del anillo ocurre siempre en posición para al activante.
Cuando el anillo aromático está activado con sustituyentes hidroxílicos, el
cierre del anillo se produce en condiciones muy suaves, debido al efecto
fuertemente activador del OH-
El análisis retrosintético de una isoquinoleina formada por el método de
Pictet-Spengler[2],
muestra las desconexiones y materiales de partida siguientes:
|
Proponer un plan de síntesis para la
siguientes Isoquinoleinas:
|
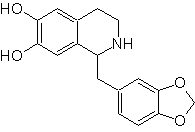
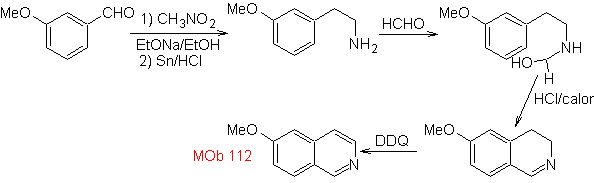
MOb 112
|
….. |
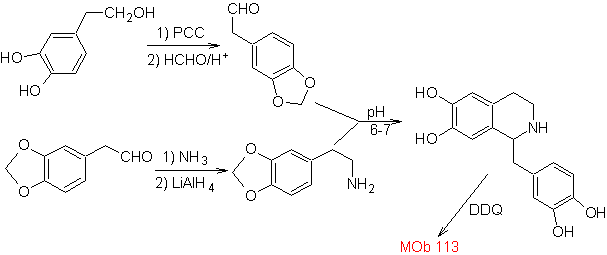
MOb 113
|
MOb 112. Análisis retrosintético.
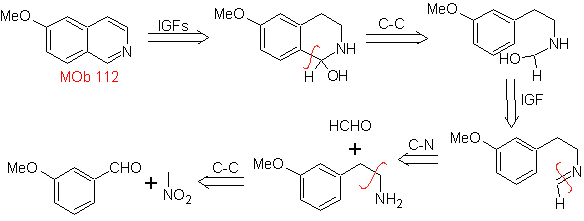
Síntesis. La ciclación
ocurre en medio ácido y se utiliza el DDG, para aromatizar la
hidroisoquinoleina formada para llegar a preparar
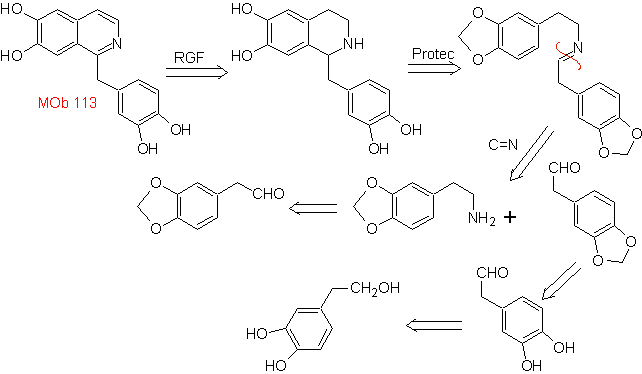
Síntesis Se aplica la síntesis de Pictet – Spengler,
para formar
[1] CASON J. Op. Cit. Pág. 665
Amé Pictet (1857-1937) fue uno de los seis miembros
de la representación suiza y actuó como secretario del Congreso de
Química de Ginebra. Como representante de
 ¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?