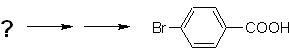SÍNTESIS DE COMPUESTOS AROMÁTICOS I
(Método del Árbol de Síntesis)
Proponer un plan de síntesis, a
partir del tolueno o xileno como materiales de partida, para las siguientes
moléculas:
|
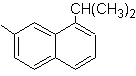
(MOb 12)
1-isopropil-7-metilnaftaleno |
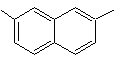
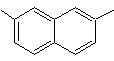
(MOb 13)
2,7-dimetilnaftaleno |
|
|
|
|
(MOb 14)
1-isopropil-6-metilnaftalen
|
(MOb 15)
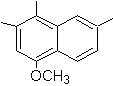
4-metox-1,2,7-trimetilnaftaleno |
Solución:
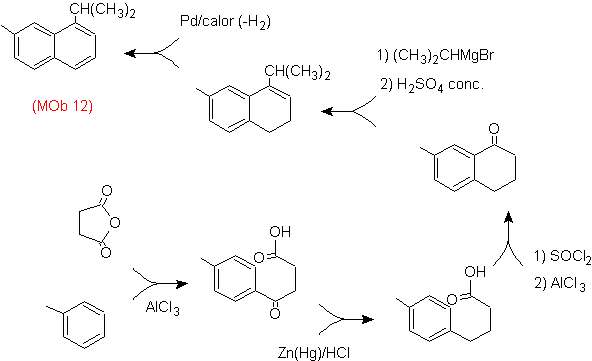
(MOb 12).
En la estrategia que se asume, se
toma en cuenta que la última etapa puede responder a un proceso de
“aromatizacion”, por lo cual se propone que la molécula precursora presenta un
anillo no aromático, con un doble enlace
sobre el carbono que contiene el doble enlace y el grupo alquilico.
Esta
estructura se puede conseguir por la acción del un Grignard sobre un carbonilo
y la posterior deshidratación del alcohol formado. La cetona se forma por la
acilación sobre el compuesto bencénico adecuado con el anhídrido succínico y
sus posteriores cierres intramoleculares de acilación de Friedel -Crafts.
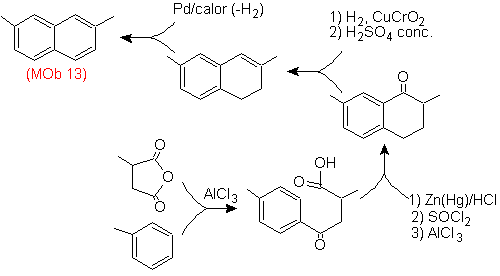
Solución (MOb
13).
Nuevamente la molécula precursora
tiene que se “aromatizada”, la estrategia mas adecuada de entre otras se basa en la combinación de acilación con
anhídrido succínico sustituido y la reducción de Clemmensen.
El
carbonilo final se reduce a alcohol que será deshidratado luego con hidrogeno
molecular y un catalizador denominado cromilo de cobre.
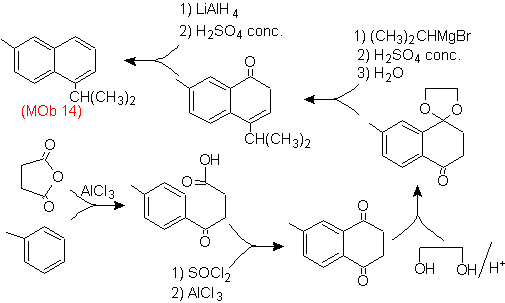
Solución
(MOb 14).
La aromatización final se
consigue, luego de reducir un grupo carbonílico a alcohol y luego deshidratarse
el mismo. La molécula precursora de consigue con una acilación con el anhídrido
succínico.
E l carbonilo que tiene que ser atacado por un Grignard
para introducir el grupo alquilo y general el alcohol que será deshidratado, es
protegido temporalmente como un acetal cíclico.
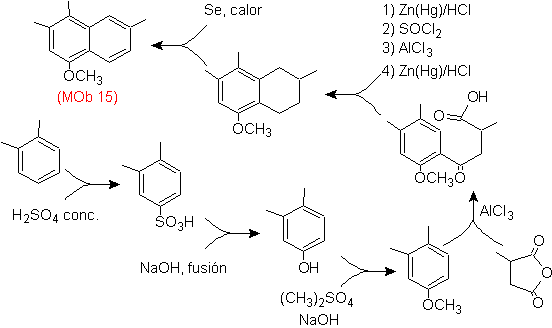
Solución MOb
15.
El anillo mas sustituido se considera que
corresponde al anillo aromático que por una acilación adecuada con un derivado del anhídrido
succínico, permitirá el cierre de un anillo, con una combinación inteligente de
la acilación y reducción del carbonilo.
El anillo bencénico con la funcionalidad requerida
se prepara a partir del o-xileno, que es sulfonado y el grupo –OH se protege
eterificándolo hasta el final.
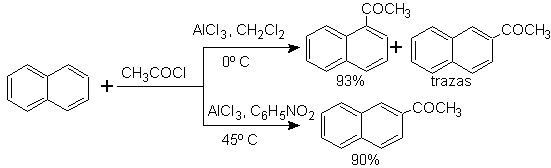
La acilación del naftaleno está
sujeta a un interesante efecto del disolvente. La reacción en disulfuro de
carbono o disolventes halogenados, produce un ataque predominantemente en la
posición a
, sin embargo, en solución de nitrobenceno, el tamaño del agente electrofílico
atacante se incrementa por solvatación con el nitrobenceno, atacándose la
posiciónb,
que es menos impedida estéricamente.
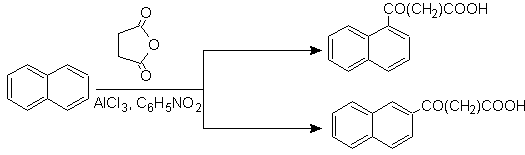
La succinoilación del naftaleno en
nitrobenceno produce una mezcla separable de isómeros a
y b,
los cuales se usan en la síntesis de derivados del fenantreno
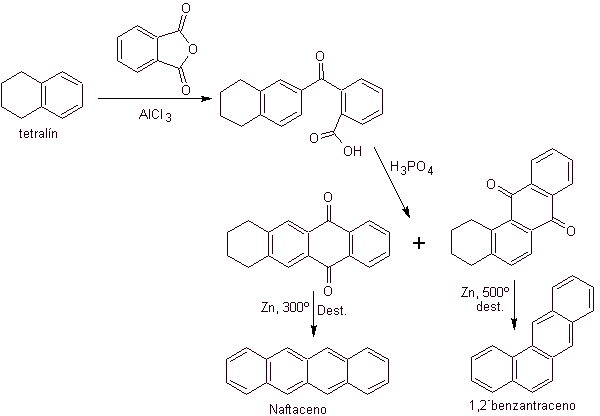
El tetralín, se acila exclusivamente en la posición b,
lo que demuestra la resistencia de los derivados 2-ftaloilo a ciclarse en la
posición 3 para dar productos condensados lineales.
|
Ejemplo:
Sintetizar el ácido p-bromobenzoico
a partir del benceno y los reactivos necesarios.
|
MOb 16 |
Solución (MOb
16).
Es necesario preguntarse “¿Cuál es un precursor
inmediato del ácido p-bromobenzoico?” El análisis retrosintético de
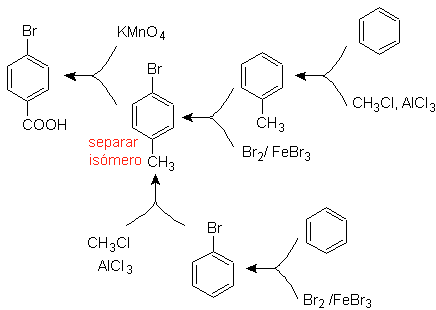
La mejor opción es la que utiliza
el tolueno como intermediario, pues el grupo metilo, es débilmente activante
del anillo bencénico y mejora el rendimiento de la formación del
p-bromotolueno.
En la segunda ruta de síntesis, se
debe tomar en cuenta que el bromo es desactivante del anillo, y el por
consiguiente el rendimiento de la reacción será obviamente mucho mas bajo que
la primera ruta. Sin embargo, se debe entender que no existe un único producto
en la síntesis, pues también se formará el isómero orto-sustituido, que deberá
ser necesariamente separado en el proceso de síntesis.
Un segundo caso, se presenta en muestra
las características de una multi-sustitución electrofílica del anillo bencénico,
es la síntesis del 4-cloro-1-nitro-2-propilbenceno (MOb. 17) a partir de
benceno.
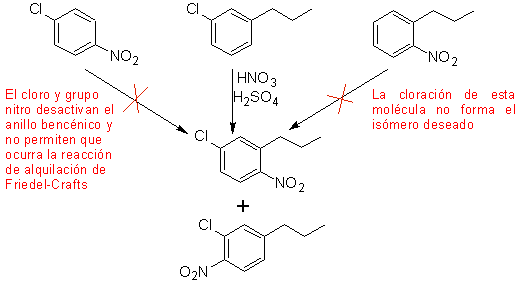
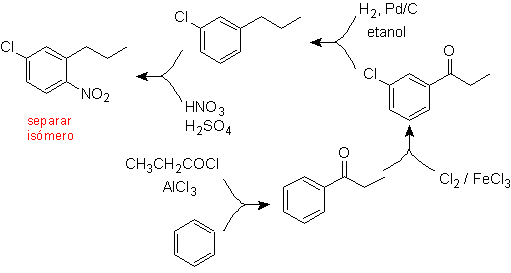
Solución (MOb 17).
En principio hay tres posibles
precursores di-sustituidos, pero sólo uno de ellos es el adecuado. También en
este caso, existe la alta probabilidad de la formación del isómero
2-cloro-1-nitro-4-propilbenceno.
La síntesis final de
Ya se tiene claro, que una de las
labores del químico, es diseñar rutas de
síntesis que conduzcan en lo posible a la formación de un único producto con
los mayores rendimientos, es decir evitando en todo el trayecto la formación de
isómeros. Para ejemplificar este aspecto, estudiaremos la síntesis de las
siguientes moléculas:
|
MOb.
18
|
|
MOb.
19
|
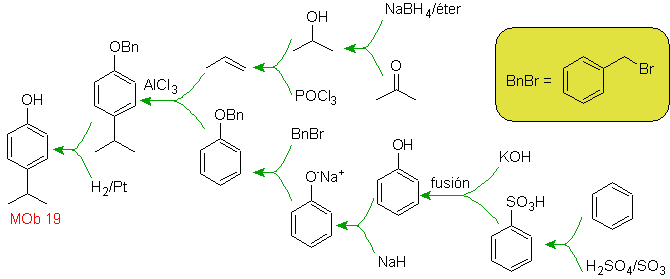
Solución
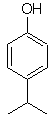
MOb 18
El bromo es un orientado orto para
y además desactivante del anillo bencénico, por lo que en la estrategia se
recurre a colocar un grupo fuertmente activante a las posiciones orto y para de
un nuevo electrófilo y luego de generar la reacción retirar el grupo activante
del anillo bencénico.
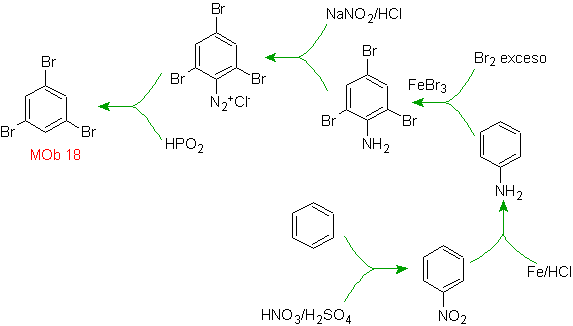
El grupo –OH es fuertemente
activante del anillo bencénico y orientador orto-para. Consiguientemente,
podemos el grupo –OH, transformarlo en un grupo mucho más grande es decir
voluminosos, que ejercerá un impedimento estérico, para cualquier electrófilo
que se aproxime al anillo y lo orientará sólo a la posición para. Finalmente se
restituirá el grupo –OH, para llegar a la molécula objetivo.