DISCONNESSIONE DEI COMPOSTI 1,4-DIOSSIGENO
Un altro gruppo di composti di grande importanza nella sintesi chimica è costituito dalle molecole diossigenate che si trovano in un rapporto di distanza di 1,4. Questi composti, se sottoposti ad un'analisi di disconnessione retrosintetica, generano sintoni, dove uno di essi, l'elettrofilo o il nucleofilo, può essere considerato "anomalo" o "illogico", perché la carica assegnata a uno degli atomi non può essere spiegata in termini della sua elettronegatività intrinseca o indotta.
1. Composti 1,4-diossigeno (1,4-diO)
In questo tipo di composti la disconnessione porta anche ad un sintone logico e ad un altro sintone illogico (non naturale), che può essere un nucleofilo o un elettrofilo, il cui equivalente sintetico deve ancora essere adeguatamente rielaborato, per poter essere utilizzato in la reazione chimica.
1. 1. Composti 1,4-dicarbonile
1.1.1. Composti 1,4-dichetonici
Le alternative di disconnessione di questo tipo di composti o molecole da sintetizzare (MOb), possono portare alle seguenti opzioni:
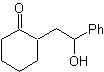
A. Un sintone anione logico e un sintone cationico illogico
L'equivalente sintetico dell'anione è lo ione enolato o l'enolo stesso del composto carbonilico. Invece l'equivalente sintetico per il carbocatione è alfa alocarbonile. (Ampololungo)
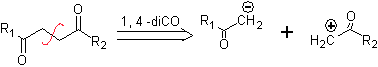
B. Un sintone logico cationico e un sintone anione illogico
L'equivalente sintetico del sintone cationico logico è il composto carbonilico α,β-insaturo. Un adatto equivalente sintetico per il sintone anionico può essere un anione nitroalcano. Il gruppo –NO 2 negli alcani può essere trasformato in C=O, mediante la reazione di Nef, oppure mediante le varianti della reazione di McMurry, dove per azione del TiCl 3, il nitroalcano si trasforma in un'immina, che è quindi viene idrolizzato in un mezzo acido nel rispettivo composto carbonilico.
1.1.2.
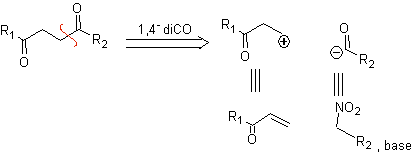
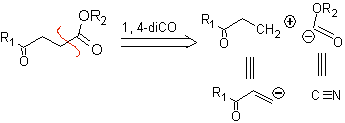
Composti 1,4-chetoesteri
γ-chetoesteri, 1,4-diesteri e 1,4-diacidi possono essere scollegati a un sintone cationico naturale, il cui equivalente sintetico è un composto carbonilico α,β-insaturo, e al composto non naturale ("illogico" ) anione synthon (-) COOR, il cui equivalente sintetico è lo ione cianuro.
Esempi: proporre un progetto di sintesi, a partire da materiali semplici ed economici, per ciascuna delle seguenti molecole:
MOb 35
| MOb 36
| |
MOb 37
| MOb 38
|
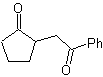
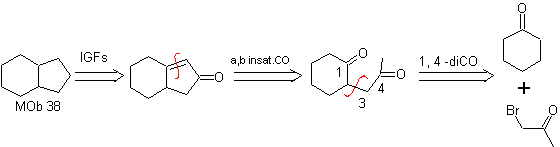
MOb 35 (a). Analisi retrosintetica . La molecola può essere disconnessa secondo il modello 1,4-diCO. Il ciclopentanone precursore generato deve essere precedentemente attivato in modo che il suo Cα sia più nucleofilo, e quindi essere utilizzato nella reazione con α.bromoacetone.
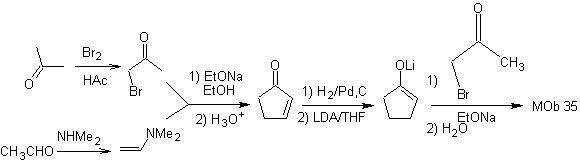
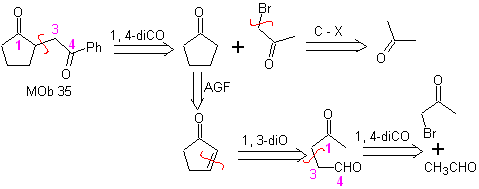 sintesi . La nucleofilia del ciclopentanone è controllata e garantita, utilizzando LDA, per arrivare a
sintesi . La nucleofilia del ciclopentanone è controllata e garantita, utilizzando LDA, per arrivare a
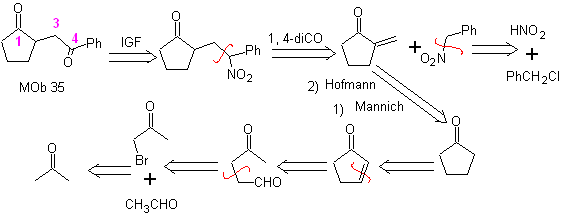
MOb 35 (b). Analisi retrosintetica . Il modello 1,4-diCO che presenta
sintesi . Allo stesso modo, l'ultima tappa, da raggiungere
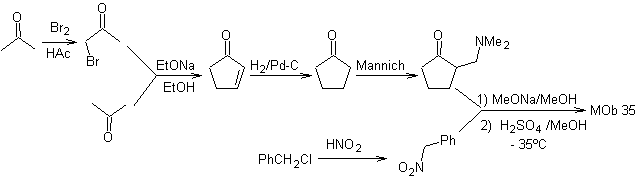
L'uso di nitroalcani o nitroareni secondari genera chetoni come prodotto, mediante la reazione Nef, motivo per cui questa metodologia è applicabile solo ai composti 1,4-chetoesteri, 1,4-chetoni e 1,4-chetoaldeidi.
MOb 36. Analisi retrosintetica. In primo luogo, il gruppo carbossilico di
Dovrebbe essere chiaro che il doppio legame nell'anello è più reattivo all'epossidazione rispetto all'altro doppio legame. La successiva disconnessione α,β-insat CO, permette di formare una struttura più facile da disconnettere dai modelli diossigenati generati nelle molecole intermedie.
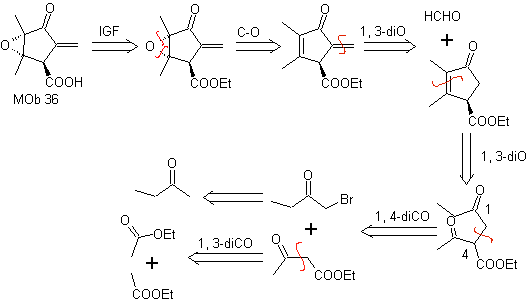
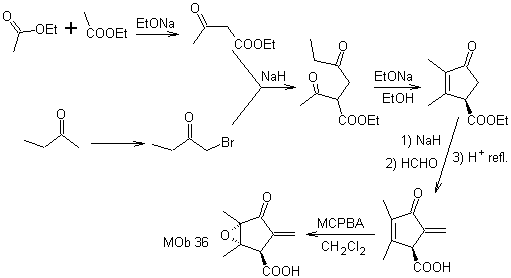
Sintesi. L'unica cura che deve essere posta in questa sintesi è l'epossidazione del doppio legame dell'anello, più reattivo del doppio legame vinilico, quindi le reazioni per arrivare alla sintesi di
MOb 37. Analisi retrosintetica: La disconnessione di
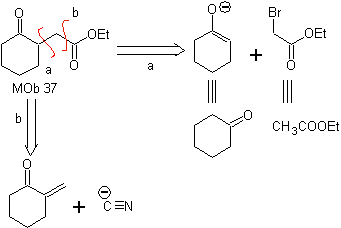
Sintesi : Segue la disconnessione (a). idrolisi
alla fine deve essere controllato, a
non influenzare il gruppo estere di MOb 37
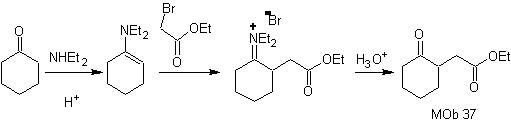
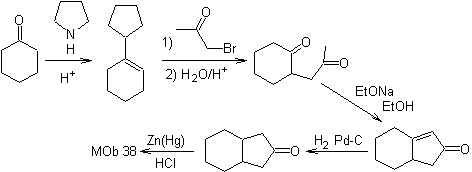
sintesi .
L'enammina del cicloesanone viene riutilizzata per spostare l'alogeno del chetone. Il composto 1,4-diCO formatosi viene ciclizzato in un mezzo basico.
2.1.2.
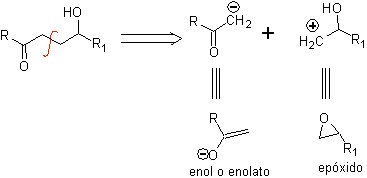
g -Composti idrossicarbonilici
Un composto γ-idrossicarbonilico corrisponde al modello 1,4-diO, motivo per cui la sua disconnessione fornisce un sintone anionico logico e un sintone cationico illogico, il cui equivalente sintetico può essere un epossido.
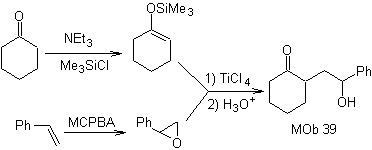
Come potrebbe essere sintetizzata la seguente molecola? | MOb 39
|
MOb 39. Analisi retrosintetica.
La disconnessione del modello
γ-idrossicarbonile, MOb 39, dà origine al cicloesanone come molecola precursore e un epossido aromatico. Bisogna cercare l'enolo o enolato del chetone, che attiva il suo Cα, per aprire l'epossido dalla parte meno ostacolata.
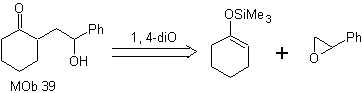
Sintesi. L'etere di sililene è un potente nucleofilo, in grado di attaccare un epossido dal lato meno protetto, in ambiente acido e catalizzato dal sale di Ti(IV).