CHINOLIN- UND ISOCHINOLIN-THEORIE
- Details
- Germán Fernández
- CHINOLIN- UND ISOCHINOLIN-THEORIE
- Zugriffe: 1349
a) Basizität
Chinolin und Isochinolin verhalten sich durch das einsame Stickstoffpaar wie Basen. In sauren Medien werden sie zu Chinolinium- und Isochinoliniumsalzen protoniert.
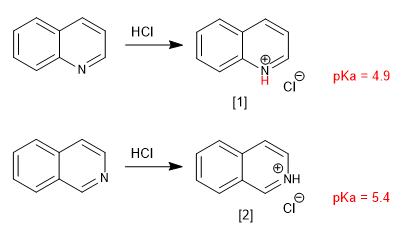
[1] Chinoliniumsalz
[2] Isochinoliniumsalz
Substituenten modifizieren die Basizität analog zu Pyridin. Donorgruppen erhöhen die Basizität und Attraktorgruppen verringern sie.
Weiterlesen: Reaktionen mit Stickstoff-Einzelpaaren: Chinolin und Isochinolin
- Details
- Germán Fernández
- CHINOLIN- UND ISOCHINOLIN-THEORIE
- Zugriffe: 1471
Chinolin und Isochinolin reagieren mit Elektrophilen über den Benzolring (Carbocyclus) aufgrund seiner höheren elektronischen Reichhaltigkeit im Vergleich zum Pyridinring. Die beliebtesten Positionen sind 5 und 8.
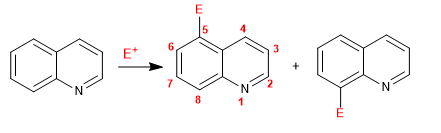
Weiterlesen: Elektrophile Substitutionsreaktion in Chinolin und Isochinolin
- Details
- Germán Fernández
- CHINOLIN- UND ISOCHINOLIN-THEORIE
- Zugriffe: 1024
N-Oxide ermöglichen die Platzierung von Elektrophilen an Position 4 des Chinolins.
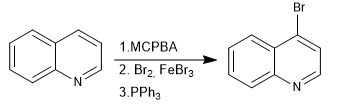
- Details
- Germán Fernández
- CHINOLIN- UND ISOCHINOLIN-THEORIE
- Zugriffe: 1136
Die Reaktion zwischen halogenierten Derivaten von Chinolin und Isochinolin mit Organolithen bei niedriger Temperatur erzeugt den Austausch von Halogen gegen das Metall, wodurch neue Organolithe am Ring erzeugt werden.
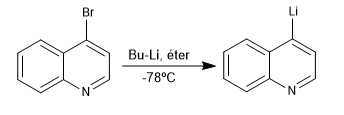
Weiterlesen: Lithiierungsreaktion in Chinolin und Isochinolin
- Details
- Germán Fernández
- CHINOLIN- UND ISOCHINOLIN-THEORIE
- Zugriffe: 1129
Die Nucleophile lagern sich an Kohlenstoff 2 des Chinolins an, obwohl es unter bestimmten Bedingungen auch an seinem Kohlenstoff 4 angegriffen werden kann.
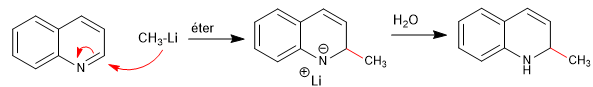
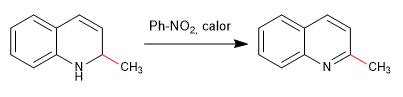
Weiterlesen: Nucleophile Addition an Chinoline und Isochinoline
- Details
- Germán Fernández
- CHINOLIN- UND ISOCHINOLIN-THEORIE
- Zugriffe: 1139
Halogenierte Chinoline in Position 2,4 gehen sehr leicht nukleophile Substitutionsreaktionen ein. Isochinolin seinerseits kann diese Reaktion nur in Position 1 geben. Alle Nucleophile mit der Fähigkeit, S N 2 zu liefern, können an dieser Reaktion teilnehmen, schlechte Nucleophile wie Wasser oder Alkohole erfordern Wärmezufuhr.
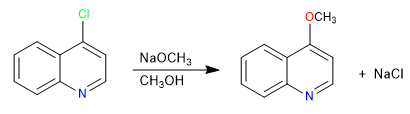
Weiterlesen: Nucleophile Substitution in Chinolin und Isochinolin
- Details
- Germán Fernández
- CHINOLIN- UND ISOCHINOLIN-THEORIE
- Zugriffe: 1066
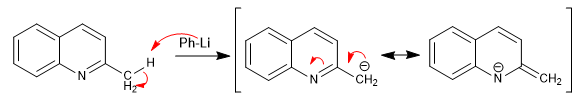
Pyridine mit Alkylgruppen in 2,4-Position haben saure Wasserstoffatome an dem Kohlenstoff neben dem Pyridinring.
- Details
- Germán Fernández
- CHINOLIN- UND ISOCHINOLIN-THEORIE
- Zugriffe: 28865
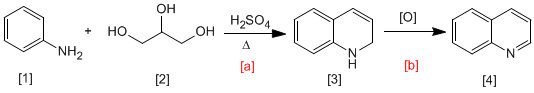
Bei der Skraup-Synthese reagiert Anilin [1] mit a,b -ungesättigten Carbonylen in saurem Medium zu 1,2-Dihydrochinolinen [3], die durch Oxidation in Chinoline umgewandelt werden [4]. Das a,b-ungesättigte Carbonyl kann durch Dehydratisierung von 1,2,3-Propantrium erhalten werden [2].
- Details
- Germán Fernández
- CHINOLIN- UND ISOCHINOLIN-THEORIE
- Zugriffe: 7370
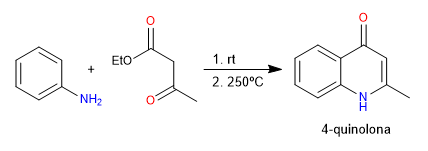
Bei der Conrad-Limpach-Synthese werden Chinolone durch Umsetzung von Anilin mit 3-Ketoestern gewonnen. Unter kinetischen Bedingungen wird das 4-Chinolon erhalten und unter thermodynamischen Bedingungen das 2-Chinolon.
- Details
- Germán Fernández
- CHINOLIN- UND ISOCHINOLIN-THEORIE
- Zugriffe: 1122
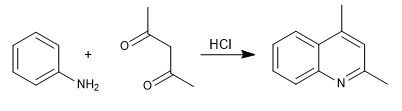
Bei der Combes-Synthese werden Chinoline durch Umsetzung von Anilin mit 1,3-Dicarbonylen unter Säurekatalyse erhalten. In einer ersten Stufe entsteht das Imin, das zu Enamin,a tautomerisiert und den aromatischen Ring durch Abgabe des Stickstoffpaares aktiviert. In der letzten Stufe erfolgt die Cyclisierung durch Angriff von Benzol auf das Carbonyl der Kette
- Details
- Germán Fernández
- CHINOLIN- UND ISOCHINOLIN-THEORIE
- Zugriffe: 1222
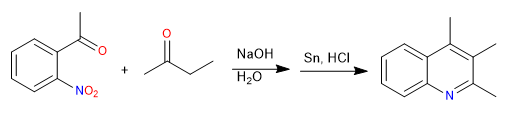
Die Friedländer-Synthese stellt Chinoline aus einem ortho-acetylierten Nitrobenzol und einem Keton her. Die Synthese beginnt mit einer Aldolkondensation in einem basischen Medium. Die Reduktion der Nitrogruppe zu Amino ermöglicht die Cyclisierung durch Iminbildung.
- Details
- Germán Fernández
- CHINOLIN- UND ISOCHINOLIN-THEORIE
- Zugriffe: 1328
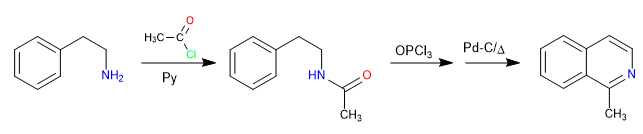
Die Reaktion zwischen 2-Aminoethylbenzol und einem Alkanoylhalogenid in Gegenwart von Pyridin bildet ein Amid. Das Amid wird durch Reaktion mit Phosphoroxytrichlorid in das Vilsmeier-Elektrophil umgewandelt. Die Cyclisierung wird durch den Angriff des Benzols auf das Elektrophil bewirkt. Eine abschließende Oxidation erzeugt Isochinolin.
- Details
- Germán Fernández
- CHINOLIN- UND ISOCHINOLIN-THEORIE
- Zugriffe: 1283
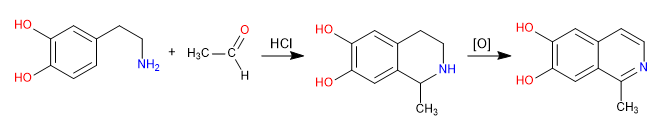
Pictet Spengler ist eine Reaktion vom Mannich-Typ. In der ersten Stufe wird das Mannich-Elektrophil durch Reaktion des Amins mit einem Aldehyd in einem salzsauren Medium gebildet. In der Endstufe erfolgt die Cyclisierung durch Angriff des Benzols auf das Mannich-Elektrophil. Das Isochinolin wird nach einer zweifachen Oxidation erhalten.
- Details
- Germán Fernández
- CHINOLIN- UND ISOCHINOLIN-THEORIE
- Zugriffe: 1180
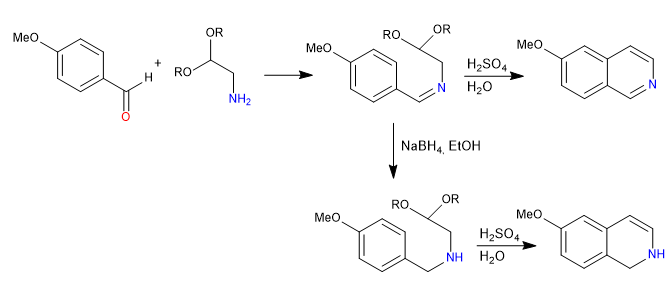
Die Pomeranz-Fritsch-Synthese stellt Isochinoline durch Umsetzung von Benzaldehyden mit geschützten a-Aminoaldehyden in Form von Acetalen her. In einer ersten Stufe wird das Imin durch Reaktion zwischen Benzaldehyd und dem Amin gebildet. In einem zweiten Schritt wird das Acetal mit wässriger Schwefelsäure gespalten, wobei der Aldehyd frei bleibt, der unter Benzolangriff cyclisiert.