A condensação da aciloína transforma ésteres [1] em alfa-hidroxicetonas [2]. Esta reação é realizada com sódio metálico em um solvente inerte. 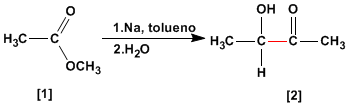
Mecanismo
No mecanismo da reação, o sódio metálico reage com o éster [1] para formar um radical ânion, que dimeriza para formar o dianion [4]. 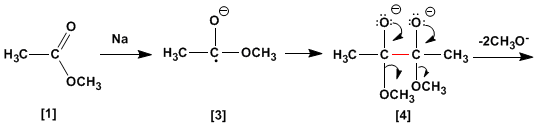
A dicetona [5] é formada pela perda de dois equivalentes de metóxido. A reação com dois equivalentes de sódio metálico converte a dicetona [5] em enediolato [6], que gera um enediol [7] no tratamento aquoso. 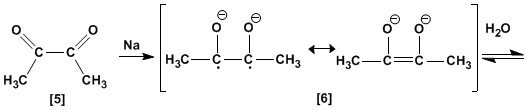
A última etapa é a interconversão entre enol e cetona, conhecida como tautomerismo ceto-enol. 
A condensação de aciloína também é um método importante para preparar ciclos médios e grandes. 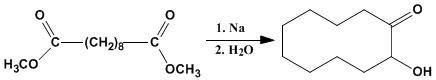
Referências
1. N. Allinger, Org. Synth. IV:840 (1963)
2. J.-P. Sauvage, Acc. Chem. Res. 1990, 23, 319-327.
3. SM McElvain, Org. reagir. 1948, 4, 256-268.
4. M. Makosza e k. Grela, Synlett. 1997:267.