Pada bagian ini kita akan mempelajari pengaruh tegangan annular pada sifat-sifat heterocycles.
A) Tegangan sudut dalam heterocycles kecil (3 dan 4 anggota).
Sudut ikatan alami dari karbon sp 3 adalah 109,5o, namun dalam siklus beranggota tiga sudut ini berkurang menjadi 60o, yang menghasilkan tegangan yang sangat besar. Untuk meredakan ketegangan ini, ikatan antar karbon yang tidak lagi lurus, membengkok, menimbulkan ikatan melengkung yang disebut “banana bond”. Sudut yang dibentuk oleh ikatan ini adalah 104o, perbedaan yang lebih dapat ditoleransi.
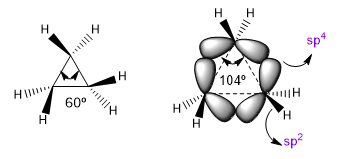
| Hibridisasi | sudut ikatan |
| sp sp 2 sp 3 sp 4 | 180º 120º 109,5º 104 |
Situasi ini membuat ikatan CC cenderung hibridisasi sp 4 teoritis sedangkan ikatan CH memiliki sp 2 . Hibridisasi ini akan memungkinkan kami untuk menjelaskan variasi dalam sifat spektroskopi dan kebasaan. Dalam spektrum inframerah diamati bahwa ketika karakter p dari suatu ikatan berkurang, penyerapan bergerak ke arah gelombang yang lebih banyak. Mari kita bandingkan amida non-siklik dengan laktam yang tertekan untuk melihat efek ini.
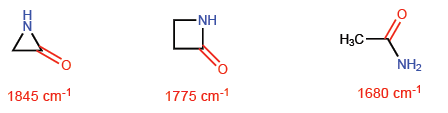
Pada azetidin-2-one, karakter p dari ikatan C=O lebih kecil daripada molekul lain dan oleh karena itu penyerapan radiasi infra merah bergerak ke arah jumlah gelombang yang lebih banyak.
Sifat lain yang dipengaruhi oleh regangan heterosiklik ini adalah kebasaan. Peningkatan karakter p dari pasangan elektron bebas menghasilkan penurunan kebasaan. Jadi, antara siklik dan amina asiklik, siklik kurang basa.
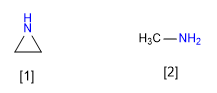
[1] Aziridin
[2] Metilamin
Aziridine kurang mendasar dibandingkan metilamina. Hibridisasi pasangan mandiri dari aziridine mendekati sp2 sedangkan metilamina adalah sp3 . Karakter p yang lebih kecil dari aziridine membuatnya kurang mendasar.
B) Stres annular dalam cincin besar. Cyclooctin dikenal sebagai alkuna siklik terkecil yang ada. Sikloalkin terkecil menghasilkan distorsi pada sudut ikatan yang sesuai dengan hibridisasi sp, menghasilkan tegangan pada molekul yang membuatnya tidak layak.
Namun, ada pengecualian untuk aturan ini yang diamati pada tiasikloheptin, yang dijelaskan oleh panjang ikatan CS yang lebih panjang dibandingkan dengan CC.
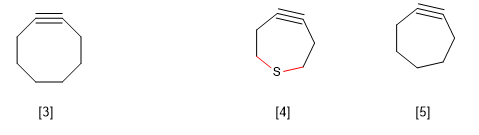
[3] Siklooktin
[4 ] Semakin panjang ikatan CS dibandingkan dengan CC memungkinkan keberadaan alkuna siklik ini.
[5] Tidak ada
C) Kekakuan sepeda.
Kekakuan bicilli, ketidakmungkinan berputar, mencegah beberapa resonansi, sehingga menimbulkan sifat anomali dalam molekul. Amida mendelokalisasi pasangan elektron bebas dari nitrogen menjadi oksigen karbonil, yang menghilangkan kebasaan nitrogen. Namun, ketika amida adalah bagian dari sistem bisiklik, penetapan ini tidak dapat dilakukan dan nitrogen tampak sangat basa.
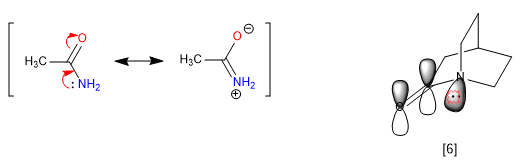
[6] Pasangan nitrogen tidak dapat ditransfer, karena orbitalnya tidak sejajar dengan karbonil.
Nitrogen oktan 1-azabisiklo[2.2.2] menghadirkan kebasaan yang luar biasa sebanding dengan amina aromatik, dengan pKa untuk asam konjugasinya sebesar 5,3. Data spektroskopi untuk amida ini juga unik. Jadi karbonil menyerap pada 1762 cm -1 , lebih khas untuk keton yang tertekan daripada amida. Penjelasannya sekali lagi terletak pada ketidakmungkinan mentransfer pasangan nitrogen bebas.
D) Kesetimbangan konformasi dalam cincin beranggotakan saudara .
Panjang ikatan CO yang lebih pendek dibandingkan dengan CC memperkenalkan kekhasan tertentu dalam kesetimbangan konformasi heterosiklik beranggota enam dengan oksigen.
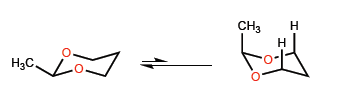
Jarak CO yang pendek menyebabkan metil bergerak lebih dekat ke hidrogen 3-posisi, sehingga menimbulkan interaksi 1,3-diaxial yang menggeser kesetimbangan konformasi ke kiri.
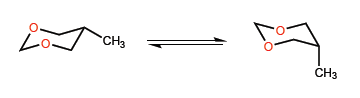
Dalam contoh kedua ini, situasinya berubah, karena interaksi antara pasangan elektron bebas metil dan oksigen tidak terlalu penting, dan gugus tert-butil bahkan dapat ditempatkan pada posisi aksial.