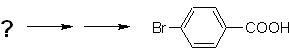SYNTHESE DES COMPOSES AROMATIQUES I
(Méthode de l'arbre de synthèse)
Proposer un plan de synthèse, utilisant le toluène ou le xylène comme matières premières, pour les molécules suivantes :
|
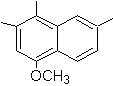
(Mob 12)
1-isopropyl-7-méthylnaphtalène |
(Mob 13)
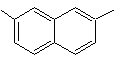
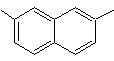
2,7-diméthylnaphtalène |
|
|
|
|
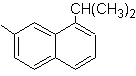
(Mob 14)
1-isopropyl-6-méthylnaphtalène
|
(Mob 15)
4-méthox-1,2,7-triméthylnaphtalène |
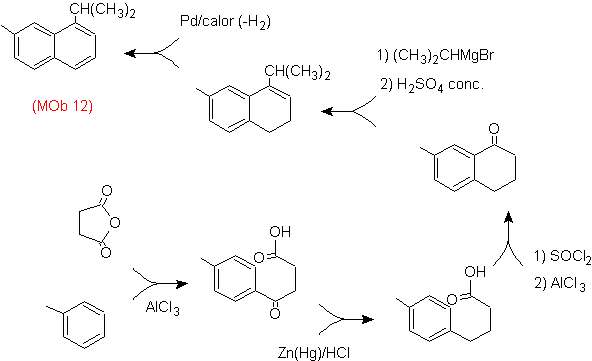
Solution : (MOb 12).
Dans la stratégie retenue, on tient compte du fait que la dernière étape peut répondre à un processus d'"aromatisation", pour lequel il est proposé que la molécule précurseur présente un cycle non aromatique, avec une double liaison. sur le carbone contenant la double liaison et le groupe alkyle.
Cette structure peut être obtenue par l'action d'un Grignard sur un carbonyle et la déshydratation subséquente de l'alcool formé. La cétone est formée par acylation sur le composé benzénique approprié avec de l'anhydride succinique et ses fermetures d'acylation intramoléculaire Friedel-Crafts ultérieures.
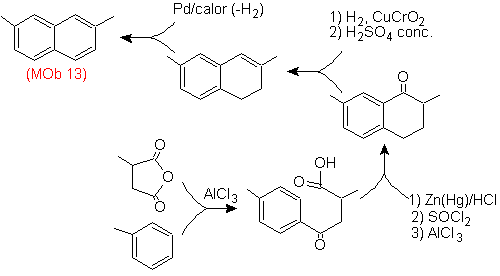
Solution (MOb 13).
Encore une fois, la molécule précurseur doit être "aromatisée", la stratégie la plus appropriée parmi d'autres Il est basé sur la combinaison de l'acylation avec l'anhydride succinique substitué et la réduction de Clemmensen.
Le carbonyle final est réduit en alcool qui sera ensuite déshydraté avec de l'hydrogène moléculaire et un catalyseur appelé cuivre chromyle.
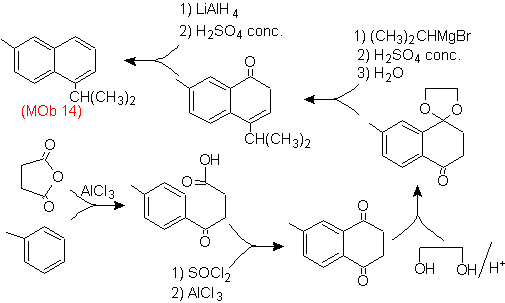
Solution (MOb 14).
L'aromatisation finale est obtenue après réduction d'un groupe carbonyle en alcool puis déshydratation. La molécule précurseur est obtenue par une acylation avec l'anhydride succinique.
Le carbonyle qui doit être attaqué par un Grignard pour introduire le groupe alkyle et générer l'alcool qui sera déshydraté, est temporairement protégé en tant qu'acétal cyclique.
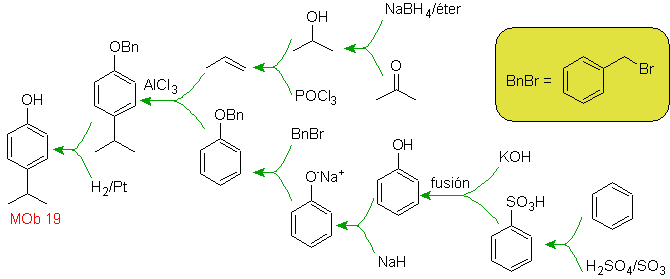
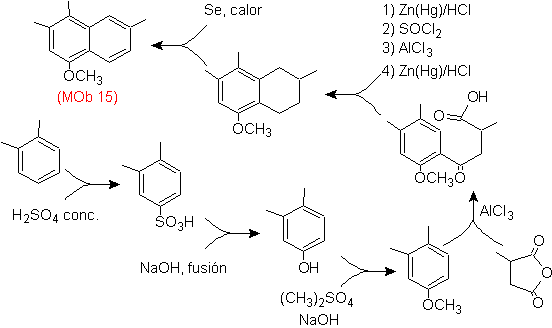
Solution Mob 15 .
Le cycle le plus substitué est considéré comme correspondant au cycle aromatique qui par acylation adapté avec un dérivé de l'anhydride succinique, il permettra la fermeture d'un cycle, avec une combinaison intelligente d'acylation et de réduction du carbonyle.
Le cycle benzénique avec la fonctionnalité requise est préparé à partir d'o-xylène, qui est sulfoné et le groupe -OH est protégé en l'éthérifiant jusqu'à la fin.
L'acylation du naphtalène est soumise à un effet solvant intéressant. La réaction dans le sulfure de carbone ou les solvants halogénés produit une attaque majoritairement en position a , cependant, en solution de nitrobenzène, la taille de l'agent d'attaque électrophile augmente par solvatation avec le nitrobenzène, attaquant la position b , qui est moins gênée stériquement.
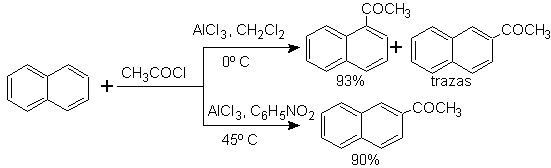
La succinoylation du naphtalène en nitrobenzène produit un mélange séparable d' isomères a et b , tous deux utilisés dans la synthèse de dérivés du phénanthrène.
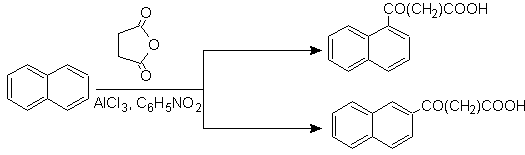
La tétraline est exclusivement acylée en position b- , démontrant la résistance des dérivés 2-phtaloyle à la cyclisation en position 3 pour donner des condensats linéaires.
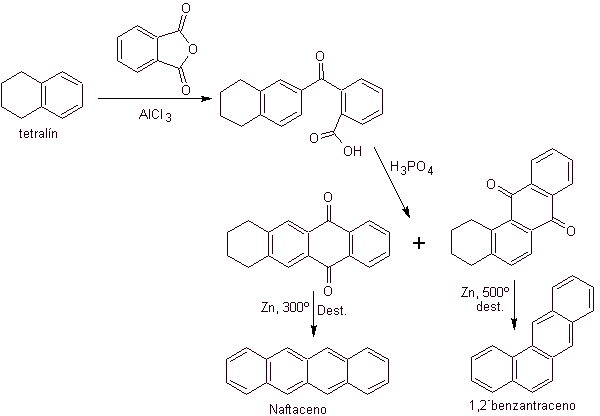
|
Exemple : Synthétiser l'acide p -bromobenzoïque à partir du benzène et des réactifs nécessaires.
|
Mob 16 |
Solution (MOb 16).
Il faut se demander "Qu'est-ce qu'un précurseur immédiat de l'acide p-bromobenzoïque ?" L'analyse rétrosynthétique de
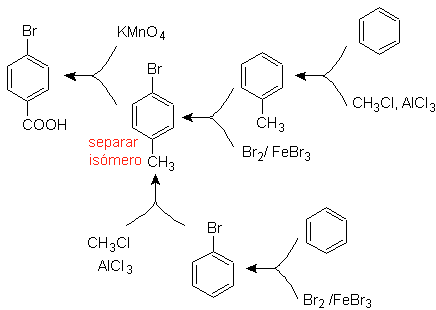
La meilleure option est celle qui utilise le toluène comme intermédiaire, car le groupe méthyle active faiblement le cycle benzénique et améliore le rendement de formation de p-bromotoluène.
Dans la deuxième voie de synthèse, il faut tenir compte du fait que le brome est désactivant le cycle, et donc le rendement de la réaction sera évidemment bien inférieur à la première voie. Cependant, il faut comprendre qu'il n'y a pas un seul produit dans la synthèse, car l'isomère ortho-substitué sera également formé, qui doit nécessairement être séparé dans le processus de synthèse.
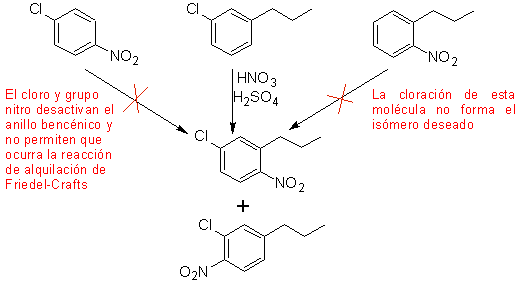
Un deuxième cas, qui montre les caractéristiques d'une multi-substitution électrophile du cycle benzénique, est la synthèse du 4-chloro-1-nitro-2-propylbenzène (MOb. 17) à partir du benzène.
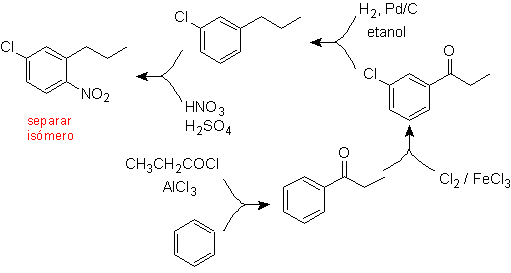
Solution (MOb 17).
En principe, il existe trois précurseurs disubstitués possibles, mais un seul d'entre eux convient. Dans ce cas également, il existe une forte probabilité de formation de l'isomère 2-chloro-1-nitro-4-propylbenzène.
l'ultime synthèse de
Il est maintenant clair que l'une des tâches du chimiste est de concevoir des voies de synthèse qui conduisent le plus possible à la formation d'un produit unique avec les rendements les plus élevés, c'est-à-dire en évitant la formation d'isomères tout au long du procédé. Pour illustrer cet aspect, nous étudierons la synthèse des molécules suivantes :
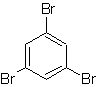
|
Foule. 18
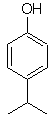
|
|
Foule. 19
|
Solution MOb 18
Le brome est orienté ortho et désactive également le cycle benzénique, de sorte que la stratégie consiste à placer un groupe fortement activateur aux positions ortho et para d'un nouvel électrophile et après avoir généré la réaction, à retirer le groupe activateur du cycle benzène.
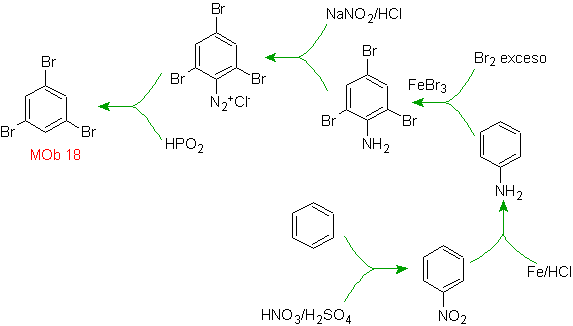
Le groupe -OH est un activateur puissant du cycle benzénique et une orientation ortho-para. Par conséquent, nous pouvons transformer le groupe -OH en un groupe beaucoup plus grand, c'est-à-dire volumineux, qui exercera un encombrement stérique pour tout électrophile qui s'approche du cycle et l'orientera uniquement vers la position para. Enfin, le groupe -OH sera restauré pour atteindre la molécule cible.