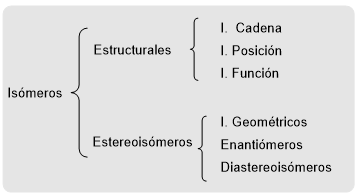
Les isomères sont des molécules qui ont la même formule moléculaire mais des structures différentes. Il est classé en isomères structuraux et en stéréoisomères. Les isomères structuraux diffèrent par la manière dont leurs atomes sont liés et sont classés en isomères de chaîne, de position et de fonction. A titre d'exemple, dessinons les isomères structuraux de formule C 2 H 6 O .

[1] Éthanol
[2] Éther diméthylique
Il n'y a que deux façons d'unir les atomes qui génèrent des composés différents. Dans l'éthanol, l'oxygène est lié à un carbone et à un hydrogène. Dans l'éther diméthylique, il est lié à deux atomes de carbone. Ce sont des isomères structuraux puisque les atomes sont liés différemment dans les deux molécules. Comme ils appartiennent à différents groupes fonctionnels (alcool et éther), ils sont classés comme isomères fonctionnels.
Le pentane et le 2-méthylbutane sont des isomères à chaîne unique, tous deux de formule C 5 H 12 . Le pentane est un alcane à chaîne droite tandis que le 2-méthylbutane a une branche.
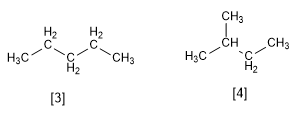
[3] Pentane
[4] 2-Méthylbutane
Notez à nouveau comment les atomes sont liés différemment dans les deux molécules.
Le 2-pentanol et le 3-pentanol sont des isomères de position. Le groupe hydroxyle occupe une position différente dans chaque molécule. 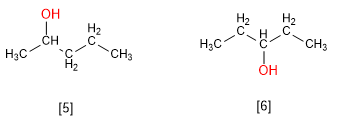
[5 ] 2-Pentanol
[6 ] 3-Pentanol
Dans les stéréoisomères, les atomes sont connectés de la même manière dans les deux molécules. La différence réside dans l'orientation spatiale différente des atomes ou groupes d'atomes. Les stéréoisomères sont classés en isomères géométriques (cis-trans), énantiomères et diastéréoisomères.