Nucleophile sind Lewis-Basen, die ein Kohlenstoffatom angreifen und die Abgangsgruppe verdrängen. Ionische Nucleophile sind weit verbreitet, aber es gibt auch zahlreiche Beispiele für neutrale Nucleophile. Das allgemeine Merkmal aller Nucleophile ist das Vorhandensein von freien Elektronenpaaren am angreifenden Atom.
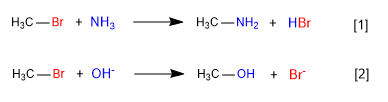
[1 ] Langsam
[2 ] Schnell
In der ersten Reaktion wirkt Ammoniak als Nucleophil – neutrale Spezies, aber mit freien Elektronenpaaren am Stickstoff – verdrängt Brom vom Kohlenstoff und bildet ein Amin.
In der zweiten Reaktion wirkt das Hydroxidion als Nucleophil, verdrängt Brom und bildet einen Alkohol. Es wird beobachtet, dass die erste Reaktion langsamer ist als die zweite, schlussendlich ist Ammoniak ein schlechteres Nucleophil als das Hydroxidion.
Die Fähigkeit eines Nukleophils, ein Substrat anzugreifen, wird als Nukleophilie bezeichnet. Die Nukleophilie hängt von mehreren Faktoren ab: Position des angreifenden Atoms im Periodensystem, Ladung und Resonanz.
Ladung - Geladene Spezies sind bessere Nucleophile als neutrale
OH ->> H 2 O Hydroxidion (geladene Spezies) besseres Nucleophil als Wasser (neutrale Spezies)
NH 2 ->> NH 3 Amidion (geladene Spezies) besseres Nucleophil als Ammoniak (neutrale Spezies)
PH 2 ->> PH 3 Phosphidion (geladene Spezies) besseres Nucleophil als Phosphin (neutrale Spezies)
Position im Periodensystem – Die Nukleophilie nimmt zu, wenn man das Periodensystem hinuntergeht und sich nach links bewegt.
NH 3> H 2 O Ammoniak ist ein besseres Nucleophil als Wasser, da Stickstoff weiter links steht als Sauerstoff
I -> Cl - Iodid ist ein besseres Nucleophil als Chlorid, weil es tiefer liegt.
PH 3> NH 3 Phosphin ist ein besseres Nucleophil als Ammoniak, da Phosphor niedriger ist als Stickstoff.
Resonanz - Resonanz verringert die Nukleophilie. Die Delokalisierung von Einzelpaaren verringert die Angriffsfähigkeit des Nukleophils.
OH -> CH 3 COO - Das Acetat-Ion ist schlechter nucleophil als das Hydroxid-Ion aufgrund von Ladungsdelokalisierung an beiden Sauerstoffatomen.