Estereoquímica
La estereoquímica es el estudio de los compuestos orgánicos en el espacio. Para comprender las propiedades de los compuestos orgánicos es necesario considerar las tres dimensiones espaciales. Las bases de la estereoquímica fueron puestas por Jacobus van’t Hoff y Le Bel, en el año 1874, asi como por Ernest L. Eliel en el siglo XX . De forma independiente propusieron que los cuatro sustituyentes de un carbono se dirigen hacia los vértices de un tetraedro, con el carbono en el centro del mismo.
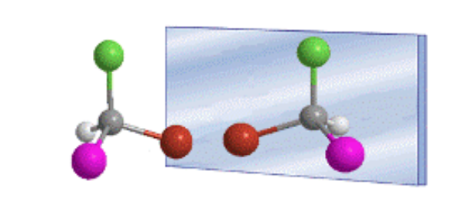
La disposición tetraédrica de los sustituyentes de un carbono sp3da lugar a la existencia de dos posibles compuestos, que son imágenes especulares no superponibles, llamados enantiómeros.
En general a las moléculas que se diferencian por la disposición espacial de sus átomos, se les denomina estereoisómeros.
Isomeria
Se denominan isómeros a aquellos compuestos que tienen idénticas fórmulas moleculares pero que se diferencian en la naturaleza o ordenación de los enlaces entre sus átomos o en la disposición de sus átomos en el espacio.
Para interpretar las diferencias en la propiedades, los químicos imaginaron, el siglo pasado, que los átomos de una molécula tenían disposiciones espaciales concretas que justificaban sus diferentes comportamientos.
La clasificación por función química, establecida según el comportamiento de los compuestos, se ha relacionado con la presencia en la molécula de un grupo de átomos llamado grupo funcional.
Además de la importancia del grupo funcional, existe una diferencia de comportamiento inducida por ligeras diferencias en la disposición de los diferentes átomos que forman el resto de la molécula. Estas diferencias pueden responder a distintas clases de isomerías :
Isomería de función
Pertenecen a este tipo de isomería los isómeros constitucionales, que se diferencian unos de otros en que sus grupos funcionales son distintos.
El grupo funcional en ambos isómeros es distinto
C2H6O
Etanol (CH3-CH2-OH) y dimetiléter (CH3-O-CH3)
El alcohol reacciona con el sodio mientras que con el éter no se observa ninguna reacción.
Del punto de vista físico, el alcohol es un líquido con una temperatura de ebullición de 78,5°C, mientras que el éter es un gas que se licua a -23°C.
Isomería de posición y/o de esqueleto.
Los grupos funcionales son idénticos pero están colocados en posiciones distintas del esqueleto molecular (isómeros de posición).
Ej: 2-hexanol y 3-hexanol :
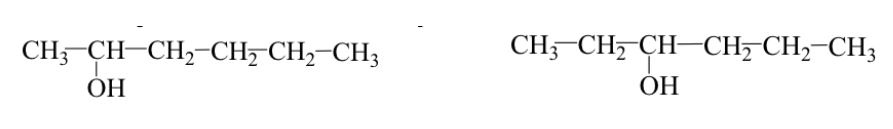
A veces el grupo alquilo tiene una disposición distinta (isómeros de esqueleto o de ramificación).
Ej: 3-metil-2-pentanol y 2-hexanol
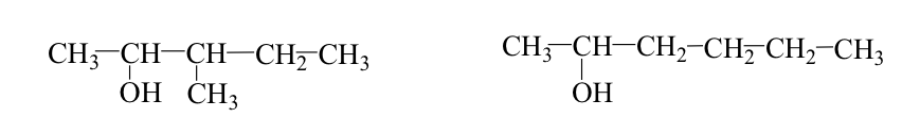
Se pueden producir los dos casos simultáneamente:
Ej : 3-metil-2-pentanol y 3-hexanol
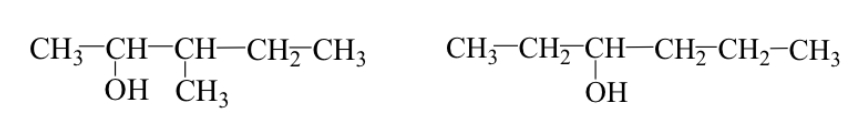
Tautomería
Son isómeros constitucionales de fácil interconversión por encontrarse entre si en rápido equilibrio. El fenómeno recibe el nombre de tautomería y suele consistir en que un átomo, generalmente de hidrógeno, situado en una triada de átomos, y un doble enlace cambian de posición simultáneamente.
El ejemplo más clásico es el equilibrio ceto-enólico (-enopara el doble enlace y -olpara el alcohol).
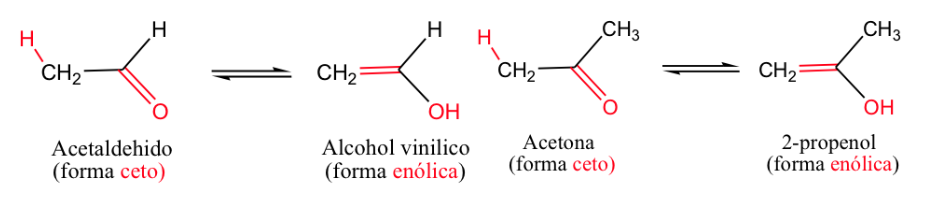
Generalmente las formas cetónicas son las más estables, pero cuando la forma enólica se estabiliza (por enlace hidrógeno o por resonancia) el equilibrio se desplaza.
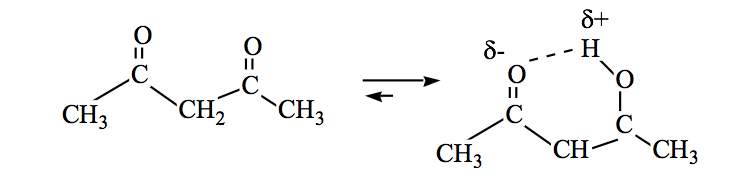
Las amidas también pueden estar en equilibrio ceto-enólico:
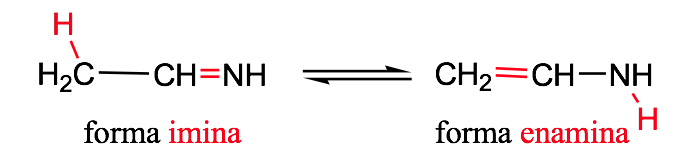
Tautomería imina-enamina:
nitro-aci
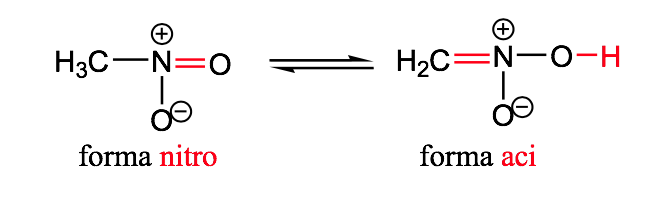
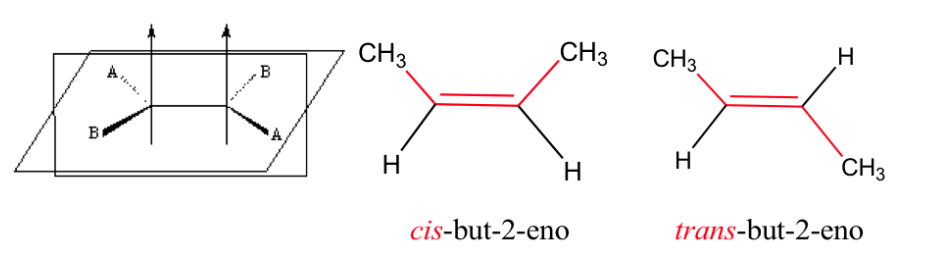
Isomería geométrica
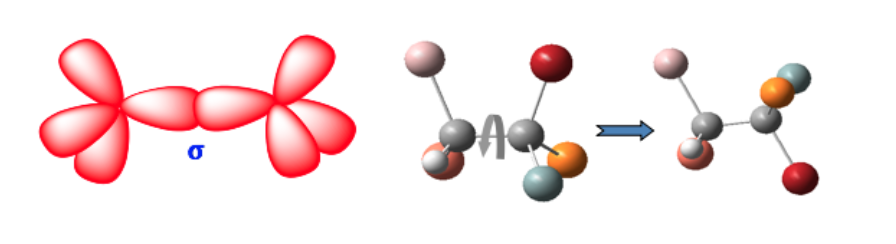
Estas dos formas no son isómeros geométricos ya que la libre rotación entorno al enlace simple convierte una forma en otra (confórmeros)
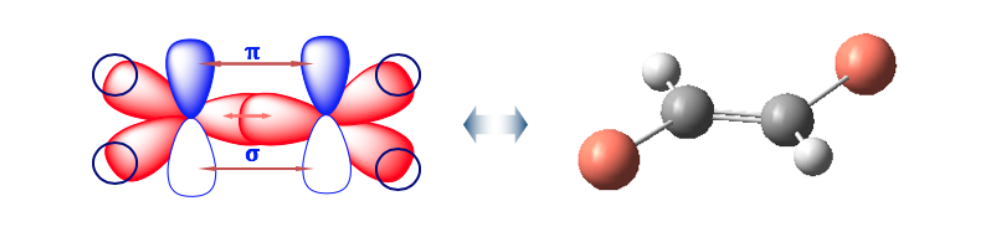
El doble enlace no permite la libre rotación lo que puede generar dos estructuras distintas dependiendo de la posición de los grupos A y B en el espacio: son isómeros geométricos.
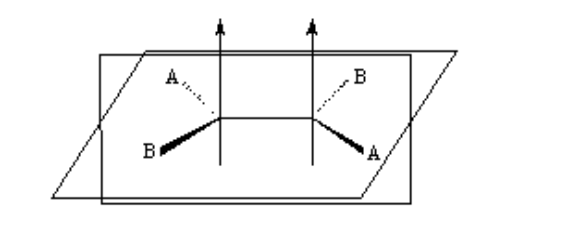
Isomería en los alquenos
Para que exista isomería geométrica se deben cumplir dos condiciones:
1.- Rotación impedida (por ejemplo por un doble enlace)
2.- Dos grupos diferentes (A y B) unidos a ambos lados del enlace
Efecto de la isomería geométrica sobre las propiedades físicas

Nomenclatura de isómeros geómétricos
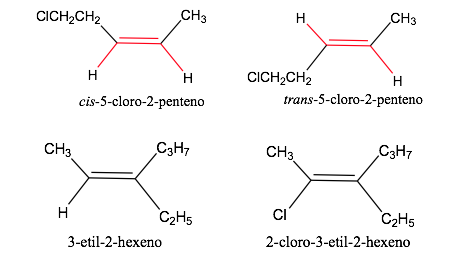 Reglas de secuencia o prioridad
Reglas de secuencia o prioridad
Las reglas que se deben tener en cuenta para establecer el orden de prioridad o preferencia de los átomos o grupos de átomos fueron establecidas en 1956 por Cahn, Ingoldy Prelogy modificadas varias veces para evitar ambigüedades.
Cuando los grupos de prioridad alta se encuentren en lados opuestos del plano perpendicular a la molécula, el isómero se llama E
Cuando están en el mismo lado de este plano el isómero se denomina Z
Ejemplo : but-2-eno :
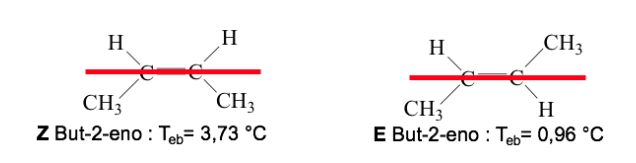
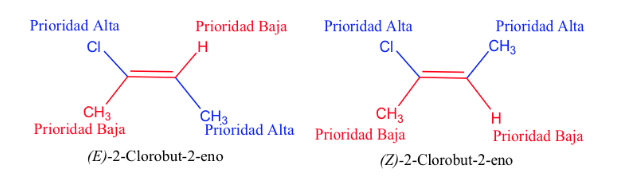
La prioridad de los sustituyentes sobre los carbonos del doble enlace se puede deducir de las siguientes reglas:
- Regla 1:
- Si los átomos unidos al átomo de carbono en estudio son distintos, tienen prioridad los del número atómico más alto sobre los del número atómico más bajo y si se trata de dos isótopos, se consideran por orden decreciente de masa atómica.
Ej : Br (35) > Cl (17) > O (8) > N (7) > C (6) > H (1)
D > H y 13C >12C
Regla 2:
Cuando los átomos unidos al átomo de carbono son idénticos (y no sirve la primera regla), se sigue la secuencia, es decir, se recurre a la comparación de los átomos unidos a ellos y, si es preciso porque fueran también iguales, a los siguientes, etc, teniendo en cuenta que si los átomos son iguales pero en número diferente, tiene prioridad el sustituyente con más átomos de rango superior.
Ej : -CH2-OH > -CH3 porque O > H
-CH2-Br > -CH2-OH porque Br > OH
-CH2-CH3> -CH3 porque C > H
Regla 3:
Los enlaces dobles y triples se tratan como si fueran sencillos, duplicando o triplicando los átomos de la cadena, respectivamente.
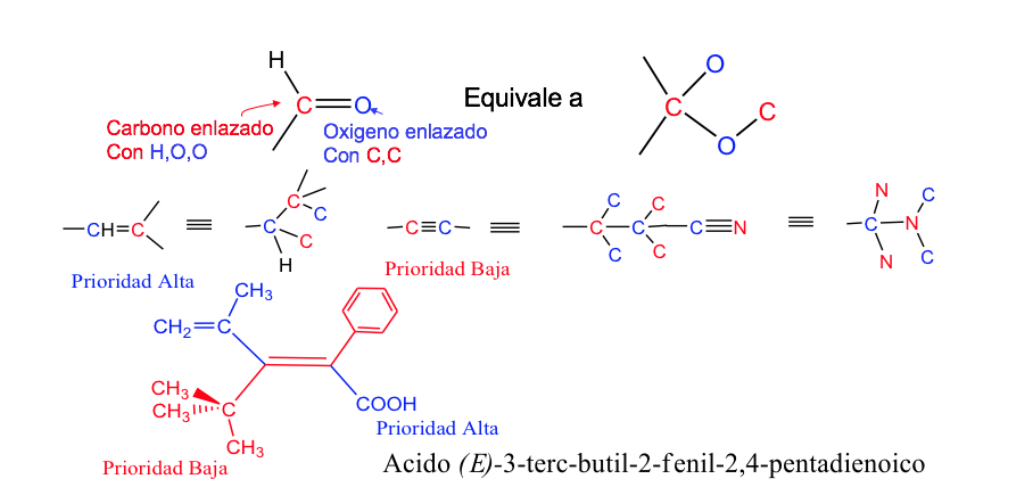
. Isomería de los ciclos y los sistemas complejos.
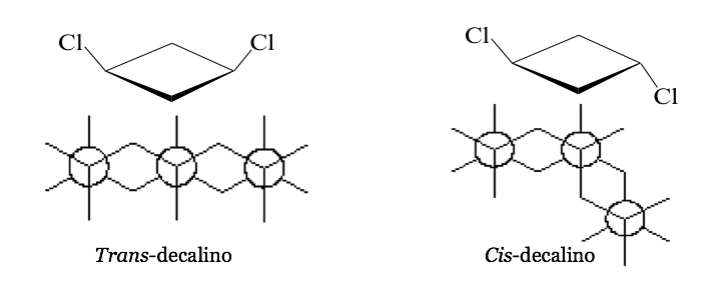
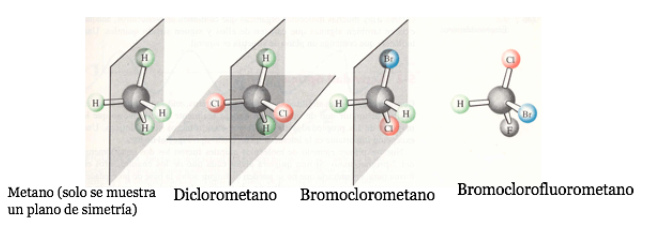
En algunas moléculas cíclicas simétricas (al menos disustituidas), los átomos del ciclo definen un plano. Un sustituyente se sitúa hacia una cara de este plano mientras que el otro puede estar situado hacia el mismo lado o hacia el lado opuesto.
Cis-1,3-Diclorociclobutano trans-1,3-Diclorociclobutano
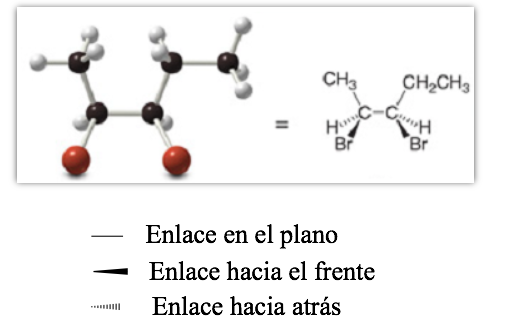
Representación proyectiva (CRAM)
Representación en perspectiva
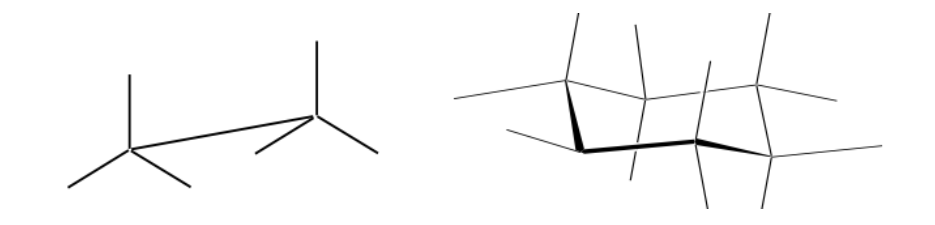
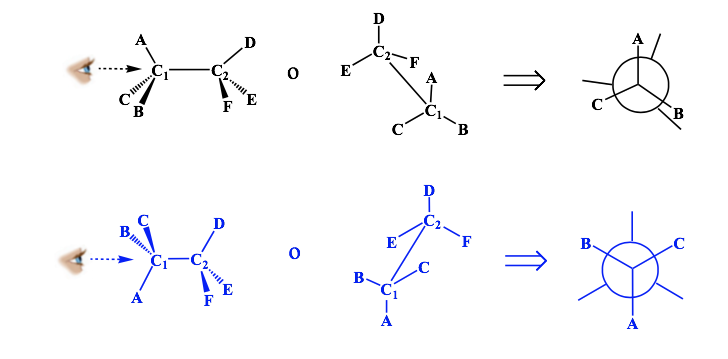
Representación de Newman
Una proyección de Newman es una forma de representación bidimensional útil para visualizar conformaciones en un enlace simple carbono-carbono de una molécula orgánica.
Representación de Fischer.
La proyección de Fisher es una forma estándar de dibujar en dos dimensiones átomos de carbono tetraédricos y sus sustituyentes.
En esa proyección cada carbono tetraédrico se representa como una cruz en la que, las líneas horizontales se dirigen hacia afuera del papel y las verticales hacia adentro.
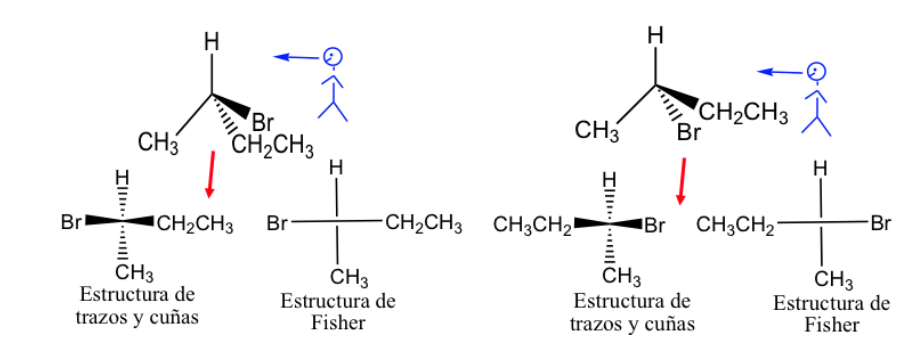
La representación de Fisher se puede hacer marcando los enlaces que estén delante del plano con trazo grueso y los situados detrás con trazo discontinuo, pero generalmente los diferentes enlaces se presentan con trazos normales, aunque se sobre entiende que los sustituyentes representados a derecha e izquierda de la línea vertical están por encima del plano de representación y los representados arriba y abajo, por debajo de ese plano.
Por convención general la cadena carbonada se presenta en la vertical poniendo el carbono más oxidado en la parte superior.
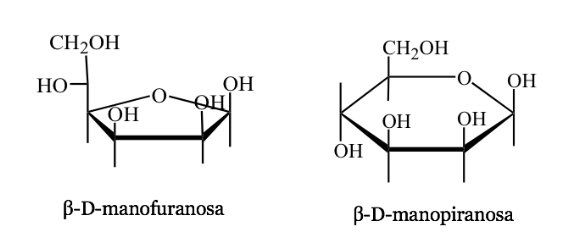
Representación de Harwoth
- Es una representación en perspectiva de las formas cíclicas de las moléculas de azúcar de 5 o 6 átomos (furanosas, piranosas).
- Ej. :
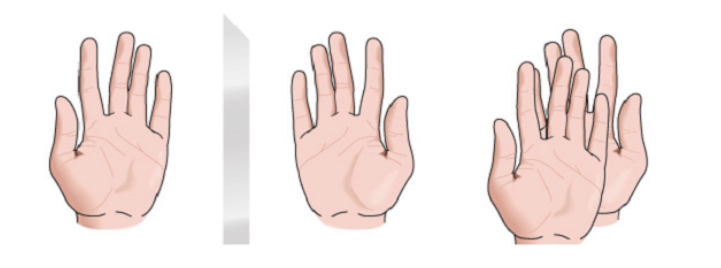
Quiralidad
Se denomina quiral toda figura geométrica, o todo grupo de puntos, cuya imagen en un espejo plano, idealmente realizada, no puede hacerse coincidir consigo misma. Algunas moléculas son como las manos. La izquierda es la imagen especular de la derecha pero no son superponibles y por lo tanto no son idénticas. Se llaman quirales.
Hay otras moléculas parecidas a un par de calcetines. Los calcetines son imágenes especulares un del otro y también son superponibles.
Una molécula o un objeto superponible a su imagen especular se denomina aquiral.
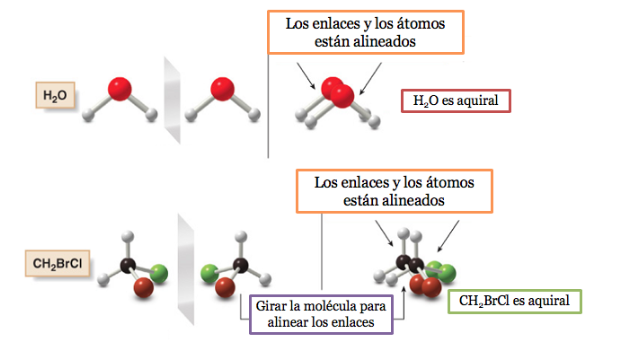
Si una molécula posee un plano de simetría es un sistema aquiral.
Una molécula quiral existe en dos formas estereoisómericas llamadas enantiómeros. Estos son objetos no superponibles con sus imágenes especulares.
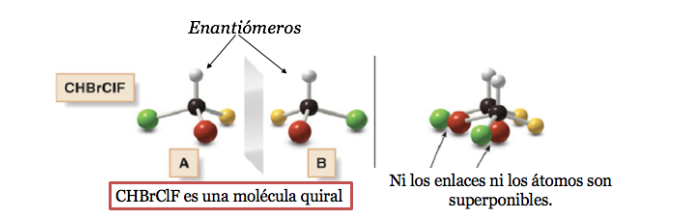
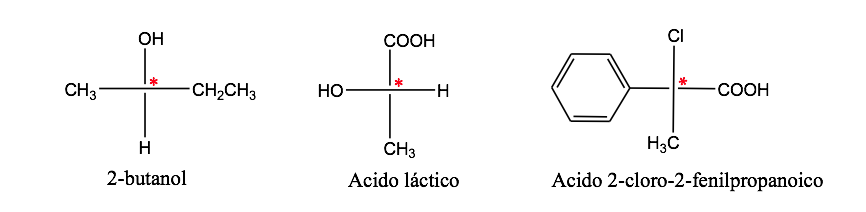
Un átomo de carbono unido a 4 sustituyentes distintos se denomina carbono asimétrico. Sin embargo su existencia no es garantía de quiralidad (como se verá más adelante). Se llama también carbono estereogénico o estereocentro.
Isomería óptica
Las propiedades físicas de dos enantiómeros son idénticas: tienen los mismos puntos de ebullición y de fusión, la misma solubilidad, la misma densidad, el mismo índice de refracción, misma conductividad...etc.
La actividad óptica de las parejas de enantiómeros es la propiedad característica para diferenciarlos.
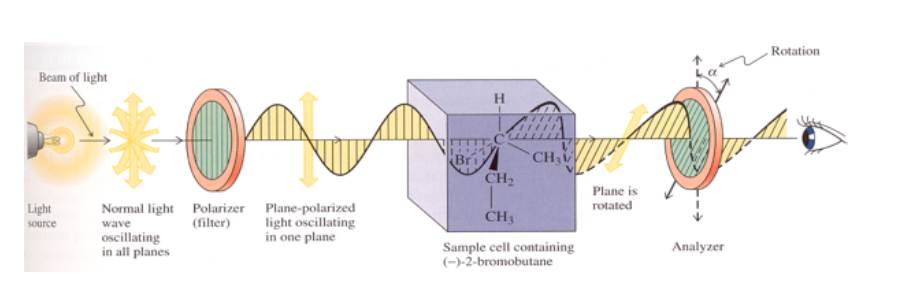
Si la sustancia no es ópticamente activa no se observa ningún cambió en el plano de vibración de la luz polarizada emitida.
Si la sustancia tiene actividad óptica se observa una rotación de agrados del plano de vibración de la luz polarizada emitida.
Si la rotación del plano de la luz es hacia la derecha (en el mismo sentido de las agujas del reloj) la sustancia es dextrógira y al valorα se le asigna signo positivo.
Si el giro es hacia la izquierda (en el sentido contrario de las agujas del reloj) la sustancia es levógira y a αse le asigna signo negativo.
La rotación específica de una molécula ópticamente activa es una constante física característica de dicha molécula

Rotación específica de algunos compuestos quirales
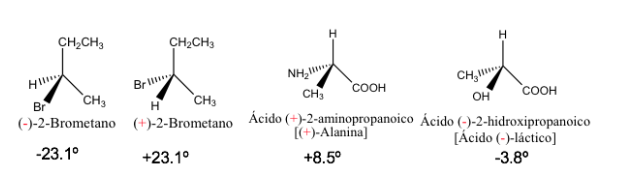
Los enantiómeros puros presentan el mismo valor de rotación específica pero de signo contrario.
Por lo tanto, la rotación óptica resultante de una mezcla 1:1 de enantiómeros es cero, es decir, es ópticamente inactiva. Este tipo de mezclas se denomina racematoo mezcla racémica.
La denominación de la configuración absoluta de un centro estereogénico se basa en la mismas reglas de prelación desarrolladas por Cahn, Ingold y Prelog.
Estas reglas permiten nombrar y describir la disposición en el espacio de los sustituyentes sobre un centro estereogénico, independientemente del signo de la rotación óptica de la molécula.
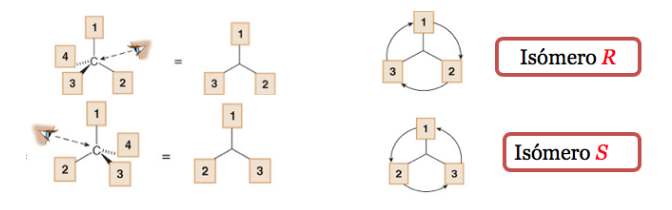
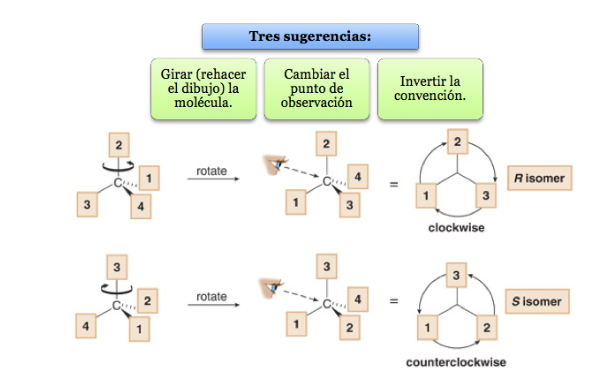
El sustituyente de menor prioridad se encuentra lo más alejado posible del observador.
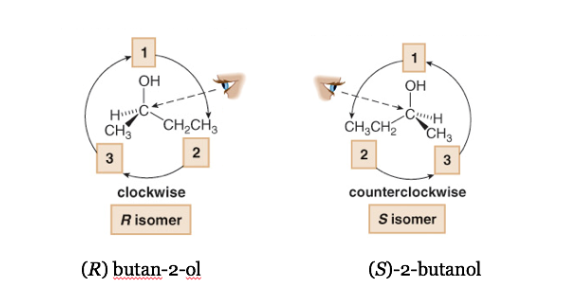
Si el paso de 1à2à3 se hace en el sentido horario, el centro quiral es R(rectus, latín, derecha).
Si el paso 1à2 à3 se hace en el sentido contrario a las agujas del reloj, la configuración del centro quiral se denomina S(sinister, latín, izquierda).
En la nomenclatura sistemática, R o Sse añaden entre paréntesis como prefijo del nombre del compuesto quiral
Es importante recordar que los símbolos R y S no muestran ningún tipo de correlación con el signo de α.
¿Que hacer cuando una molécula no está orientada de manera que el grupo de menor prioridad esté alejado?
Un compuesto con ncentros estereogénicos tiene un máximo de 2n estereoisómeros.
Ejemplo:
Un compuesto con dos centros estereogénicos tiene un máximo de 4 estereoisómeros.
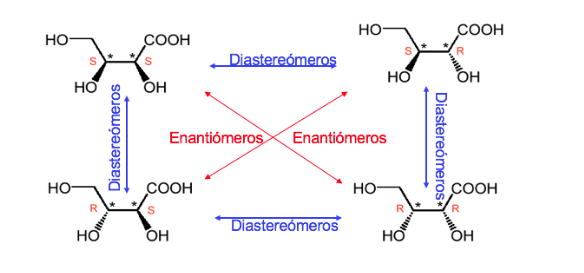
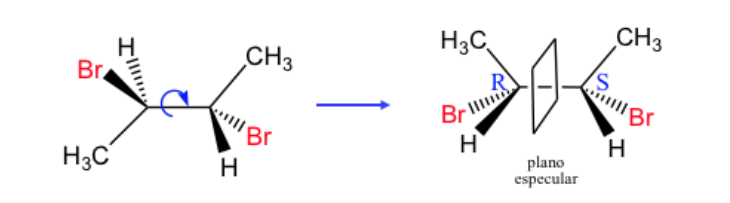
Se llama forma o compuesto meso a todo esteroisómero cuya molécula no es quiral a pesar de poseer centros estereogénicos
Un compuesto con dos carbonos asimétricos se domina like cuando los dos carbonos tienen la misma configuración absoluta y unlike en el caso contrario.
Compuestos eritro y treo
Cuando dos carbonos tienen al menos dos sustituyentes idénticos se puede usar la denominación treoy eritro.
Un par de enantiómeros eritro es aquel en el que los grupos idénticos se pueden poner en posición eclipsada.
No hay una relación directa entre la nomenclatura Ry Sy la nomenclatura Eritro/Treo .
Cuando dos carbonos tienen tres sustituyentes idénticos la forma eritro es mesoya que presenta un plano de simetría.
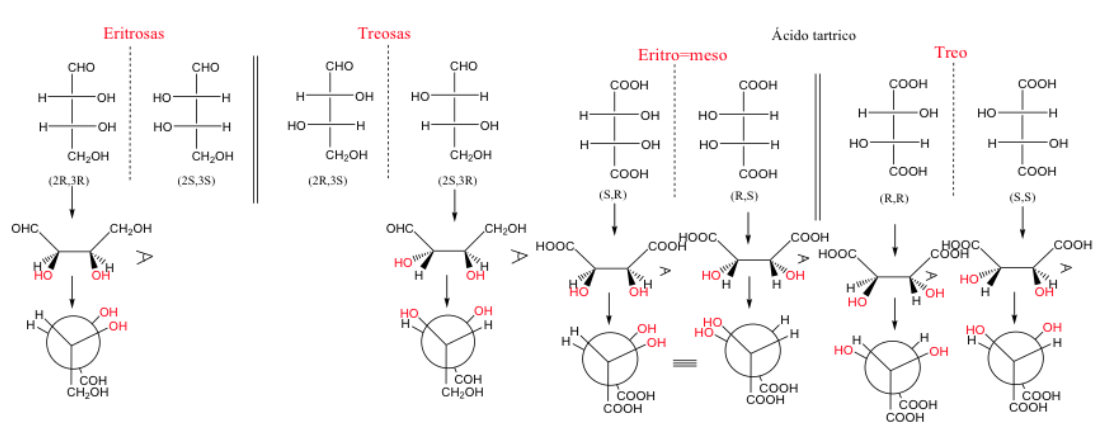
Una molécula recibe el nombre de eritrocuando, en su representación de Fischer, los grupos iguales o parecidos están al mismo lado.
Un molécula es treo si estos grupos están en los lados opuestos.
(usada generalmente para los azúcares (osas))
Es una nomenclatura anterior a la nomenclatura Ry S.
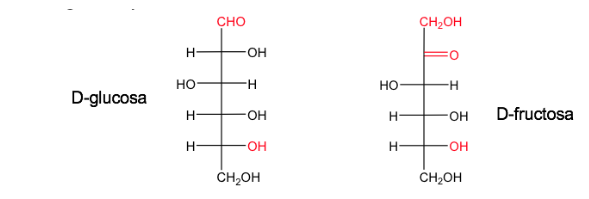
Un azúcar es nombrado D cuando, en la proyección de Fischer (con el carbono más oxidado situado arriba)el hidroxilo asociado al carbono asimétrico de mayor numeración queda a la derecha.
Su enantiómero se llamara Ly tendrá el OH equivalente a la izquierda.
La glucosa y la fructosa en sus formas naturales existen como D.
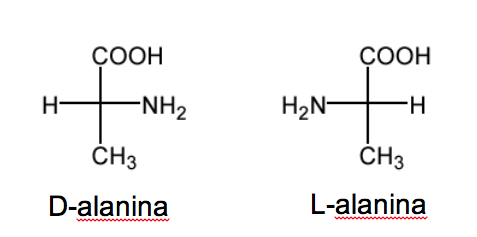
La nomenclatura D/L se emplea también en la serie de los aminoácidos
RCH(NH2)COOH.
En los azúcares esta nomenclatura depende de la posición del hidroxilo. En este caso es la posición del grupo amino la que define la nomenclatura. Cuando en la proyección de Fisher (con el carbono más oxidado arriba) el grupo NH2 está en la derecha el etereoisómero es D y su enantiómero es L.
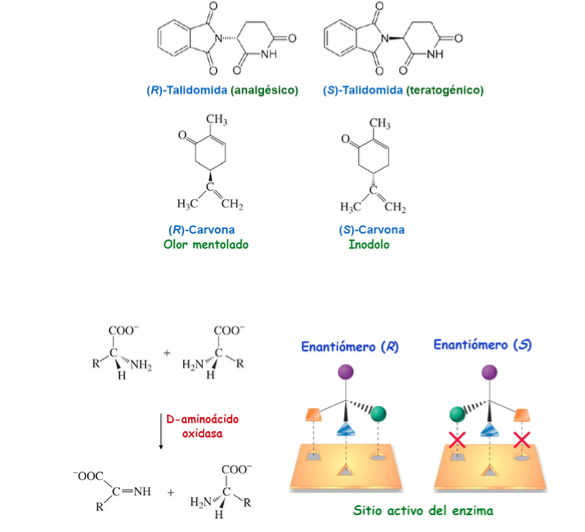
Importancia de la quiralidad
Fuentes para expandir la busqueda de conocimiento:
1) Juaristi E. “Introduccion a la estereoquimica y al analisis conformacional”. CINVESTAV, México, 1988 Juaristi E. . CINVESTAV, México, 1994.
2) Neil S. I. “Physical Organic Chemistry” Longman, Milan, 1995.
3) March J., “Advanced Organic Chemistry” John Wiley & Sons, New York, 1992 4) Jones R. A. Y. “Physical and Mechanistic Organic Chemistry”, 2nd. Ed Cambrige University Press, Cambrige, 1984 .
5) Woodward R. B. y Hoffmann R. “The conservation of orbital symmetry”, Academic Press, New York, 1979.
6) Carpenter B. K. “Determination of Organic Reaction Mechanisms”, John Wiley & Sons, New York, 1984 .
 ¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?