Organocatálisis asimétrica
Introducción
A pesar de la importancia de la quiralidad, la obtención de moléculas quirales en forma enantioméricamente pura ha permanecido extremadamente limitada hasta muy recientemente. Desde finales del siglo XIX, la síntesis de moléculas quirales de forma estereoselectiva ha constituido un reto sintético de gran magnitud al que los químicos orgánicos han respondido con gran ingenio y brillantez.
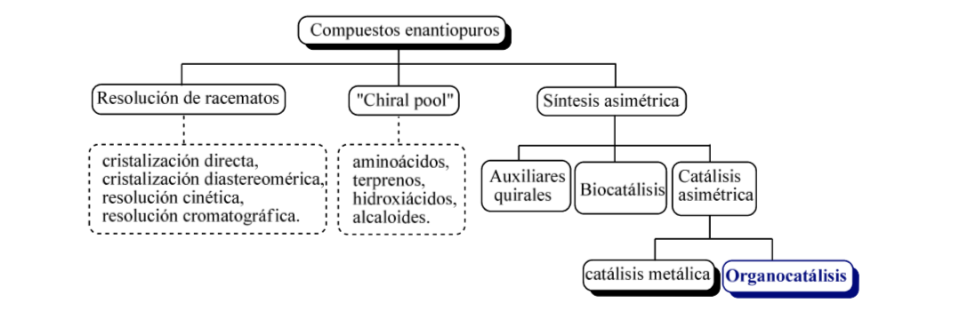
En grandes líneas se pueden considerar tres estrategias básicaspara la obtención de compuestos enantioméricamente puros, como son
a) la resolución de racematos,
b) la utilización de moléculas naturales ópticamente activas
c) la síntesis asimétrica.
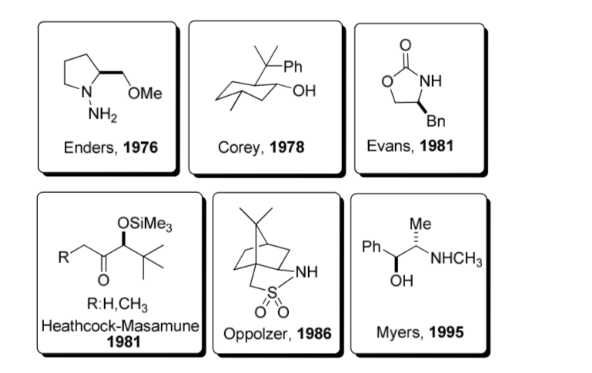
Uso de auxiliares quirales :
Un auxiliar quiral es un compuesto quimico o unidad que se incorpora temporalmente a una síntesis orgánica para que pueda llevarse a cabo asimétricamente, con la formación selectiva de uno de dos enantiómeros
Esta estrategia adquirió un auge considerable en la década de los 80 y en la actualidad se conoce una abundante gama de auxiliares para un gran número de reacciones. Algunos de los auxiliares más representativos se muestran en la figura
¿Qué es la organocatálisis asimétrica?
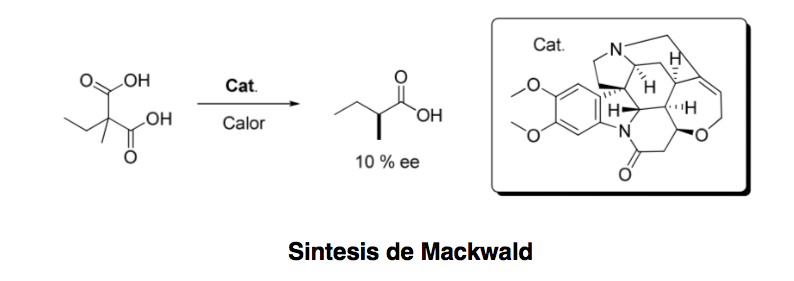
La organocatálisis asimetrica o catalisis asimetrica puede definirse como “la aceleración de reacciones químicas con una cantidad subestequiométrica de un compuesto orgánico, el cual no contiene ningún átomo metálico haciendo uso de moleculas organicas de naturaleza quiral”.Aunque el primer ejemplo de una transformación enantioselectiva organocatalítica data de 1904, cuando Mackwald llevó a cabo la descarboxilación de un derivado de un ácido en presencia de brucina,no ha sido hasta hace unos pocos años cuando este campo ha experimentado un resurgimiento espectacular.
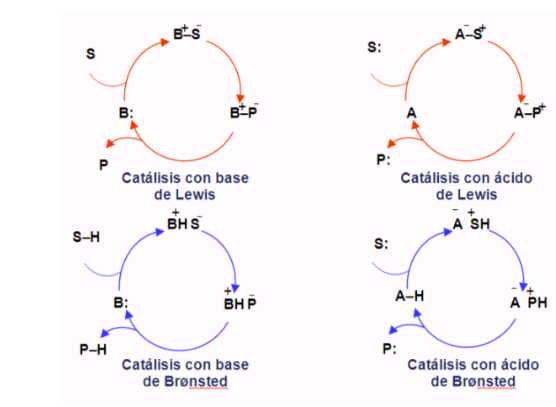
Ciclos organocatáliticos
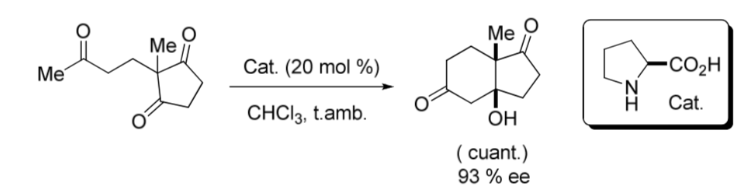
Un hito importante en el área de la organocatálisis asimétrica lo constituyó la reacción aldólica intramolecular catalizada por la L-Prolina publicada a finales de los años 60 y principios de los 70, por los grupos de Hajos y Parrish;y por otro Ender, Wiechert y Sauerindependientemente como se muestra en la siguiente imagen:
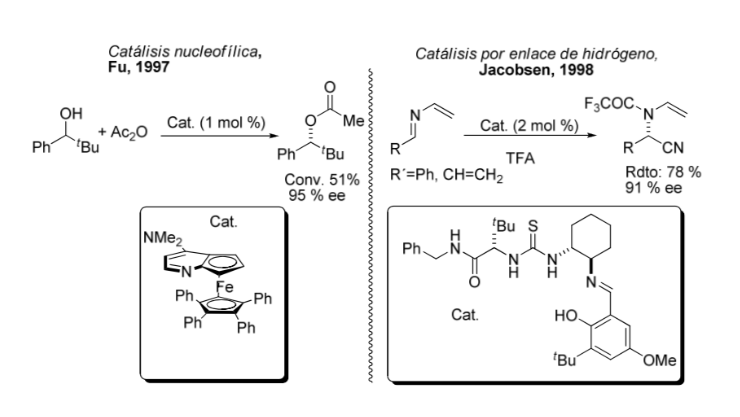
Comparacion entre catalisis organometalica y asimetrica:
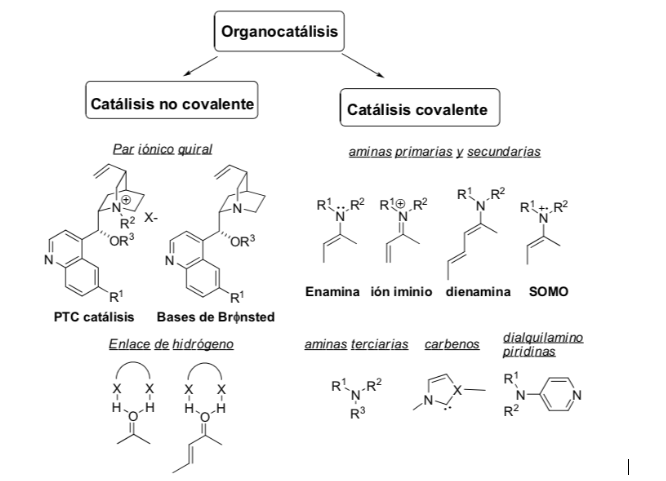
Método de activación:
Fuentes para expandir la busqueda:
Berkessel, A. y Groeger, H. Asymmetric organocatalysis: from biomimetic concepts to applications in asymmetric synthesis”, Wiley-VCH: Weinheim, 2005.
Bui, T., Syed, S. y Barbas, C.F., Thiourea-Catalyzed Highly Enantio- and Diastereoselective Additions of Oxindoles to Nitroolefins:Application to the Formal Synthesis of (+)-Physos- tigmine, J. Am. Chem. Soc. 131, 8758-8759, 2009.
Hernández-Rodríguez, M. y Juaristi, E., Structurally simple chiral thioureas as chiral solvating agents in the enantiodis- crimination of carboxylic acids, Tetrahedron 63, 7673- 7678, 2007.
Juaristi, E. Premio Nobel de Química 2001: La importancia de la síntesis asimétrica, Educ. quím. 13, 6-7, 2002. .
Juaristi, E. Síntesis asimétrica de aminoácidos valiosos, en Apor- taciones científicas y humanísticas mexicanas en el siglo XX, Paredes, O. y Estrada, S., Eds., Fondo de Cultura Económi- ca: México, 2008, p. 440-446.
Juaristi, E. Enantioselective synthesis of â-amino Acids, Wiley- VCH: Nueva York, 1997.
Juaristi, E. y Soloshonok, V. A. (Eds.) Second edition of enantiose- lective synthesis of â-amino acids, Wiley: Nueva York, 2005. Liu, Y., Melgar, R. y Juaristi, E. Enantioselective amination of
á-phenyl á-cyanoacetate catalyzed by chiral amines incor- porating the á-phenylethyl auxiliary, J. Org. Chem. 72, 1522-1525, 2007.
MacMillan, D. W. C., The advent and development of organo- catalysis, Nature455, 304-308, 2008.
Marigo, M., Juhl, K. y Jorgensen, K. A., Catalytic, highly enan- tioselective, direct amination of beta-ketoesters, Angew. Chem., Int. Ed. 42, 1367-1369, 2003.
Mukherjee, S.; Yang, J.W.; Hoffmann, S.; List, B., Asymmetric enamine catalysis, Chem. Rev. 107, 5471-5569, 2007.
Olivares-Romero, J. L. y Juaristi, E., Synthesis of Two Novel Chiral Diamines Derived from (S)-Proline and their Eva- luation as Precursors of Diazaborolidines for the Catalytic Borane-Mediated Enantioselective Reduction of Prochiral Ketones, Tetrahedron 64, 9992-9998, 2008.
Seayad, J. y List, B., Asymmetric organocatalysis, Org. Biomol. Chem. 3, 719- 724, 2005.
Simon,L.yGoodman,J.L.,MechanismofBINOL−Phosphoric Acid-Catalyzed Strecker Reaction of Benzyl Imines, J. Am. Chem. Soc. 131, 4070-4077, 2009.
Tanaka, K., Mori, A. y Inoue, S., The cyclic dipeptide cyclo[(S)- phenylalanyl-(S)-histidyl] as a catalyst for asymmetric addi- tion of hydrogen cyanide to aldehydes, J. Org. Chem. 55, 181-185, 1990.
 ¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?