Química click
“Química click "es un término que fue introducido por KB Sharpless en 2001 para describir reacciones de alto rendimiento, amplio alcance, crear solo subproductos que se pueden eliminar sin cromatografía, son estereoespecíficos, fáciles de realizar y se pueden realizar de manera fácil de eliminar. o solventes benignos. Este concepto se desarrolló en paralelo con el interés dentro de las industrias farmacéutica, de materiales y otras en la capacidad de generar grandes bibliotecas de compuestos para la investigación en investigación de descubrimiento. Se han identificado varios tipos de reacción que cumplen estos criterios, termodinámicamente reacciones favorecidas que conducen específicamente a un producto, tales como reacciones de apertura de anillo nucleofílico de epóxidos y aziridinas, reacciones de carbonilo de tipo no aldólico, tales como formación de hidrazonas y heterociclos, adiciones a enlaces múltiples carbono-carbono, tales como formación oxidativa de epóxidos y Adiciones de Michael, y reacciones de cicloadición.
Por ejemplo,la cicloadición de azida-alquino muestra que cumple con muchos de los requisitos previos. Muchos de los alquinos monosustituidos de partida y azidas orgánicas están disponibles comercialmente, muchos otros pueden sintetizarse fácilmente con una amplia gama de grupos funcionales, y su reacción de cicloadición da 1,2,3-triazoles de forma selectiva.
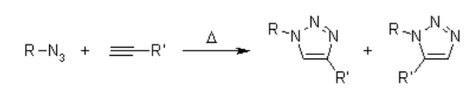
Desafortunadamente, la cicloadición huisgen 1,3-Dipolar de los alquinos a las azidas requiere temperaturas elevadas y, a menudo, produce mezclas de los dos regioisómeros cuando se utilizan alquinos asimétricos. En este sentido, la cicloadición 1,3-dipolar clásica falla como una verdadera reacción de clic. Una variante catalizada por cobre que sigue un mecanismo diferente se puede realizar en condiciones acuosas, incluso a temperatura ambiente. Además, mientras que la cicloadición clásica 1,3-dipolar de Huisgen a menudo da mezclas de regioisómeros, la reacción catalizada por cobre permite la síntesis de los regioisómeros 1,4-disustituidos específicamente. Por el contrario, una reacción catalizada por rutenio desarrollada más tarde da la regioselectividad opuesta a la formación de triazoles disustituidos en 1,5. Por lo tanto, estas reacciones catalizadas cumplen plenamente con la definición de química de clics y se han centrado en la cicloadición de azida-alquino como una reacción de clic prototipo.
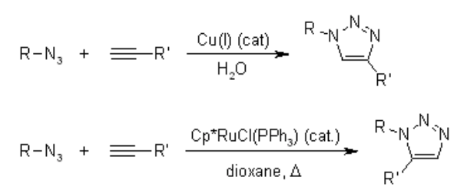
Mecanismo de la cicloadición 1,3-dipolar Huisgen Azide-Alkyne:
Para conocer el mecanismo, se debe leer sobre la cicloadición 1,3-dipolar presente también en muchas ozonolisis . Esta reacción es altamente exotérmica, pero la barrera de activación alta es responsable de una velocidad de reacción muy baja, incluso a temperaturas elevadas. Otro inconveniente es la formación de regioisómeros, ya que las dos posibles interacciones HOMO-LUMO de los sustratos están estrechamente relacionadas en términos de energía. Por lo tanto, la reacción térmica a menudo da aproximadamente 1: 1 mezclas de los regioisómeros tanto sustituidos en 1,4 como en 1,5.
 ¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?