Para que una molécula absorba radiación infrarroja deben cumplirse dos condiciones:
- La frecuencia de la radiación (fotón) debe ser la adecuada para permitir la transición entre estados vibracionales. Dicho de otro modo, la frecuencia de la radiación debe coincidir con la frecuencia natural del movimiento vibracional.
- Una molécula sólo absorbe radiación infrarroja cuando su momento dipolar interacciona con el campo electrico de la onda, variando en fase con este. Como es lógico este acoplamiento sólo es posible si las frecuencias de la radiación y la vibración del enlace coinciden. Por ello, moléculas apolares no absorben en el infrarrojo y moléculas poco polares dan lugar a absorciones muy débiles.
- Regla de selección de la espectroscopía infrarroja: "sólamente aquellos enlaces cuya vibración provoque un cambio en el momento dipolar de la molécula absorben en el infrarrojo".
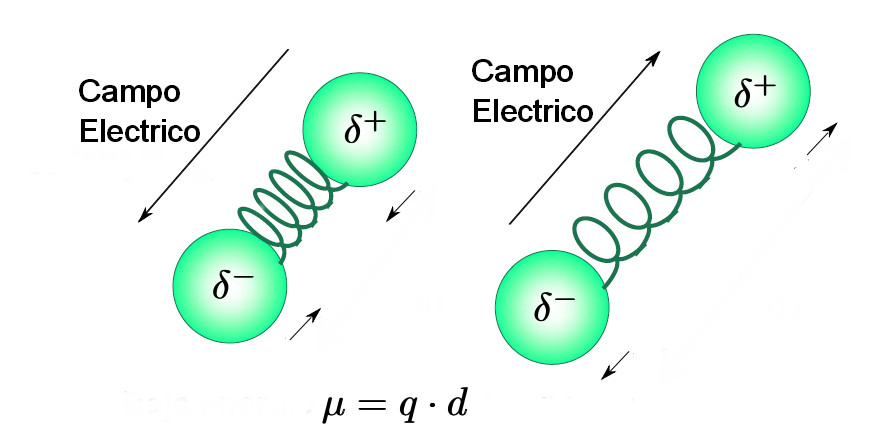
- Además, cuanto mayor sea la variación del momento dipolar durante la vibración, más intensa es la banda de absorción en el espectro. Dan lugar a bandas intensas la vibraciones de enlaces C=O, O-H, N-H y no son observables vibraciones de tensión de enlaces triples en alquinos simétricos o alquenos trans con cadenas iguales.
 ¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?