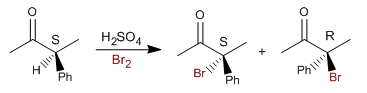
Erklären Sie, warum eine Lösung von (S)-3-Phenyl-2-butanon in wässrigem Ethanol, wenn sie mit Säuren oder Basen behandelt wird, allmählich ihre optische Aktivität verliert. (b) Warum läuft die Racemisierung der Verbindung aus dem vorherigen Abschnitt in einem sauren Medium mit der gleichen Geschwindigkeit ab wie die Halogenierung in einem sauren Medium? (c) Warum erfolgt die Jodierung dieser Verbindung in einem sauren Medium mit der gleichen Geschwindigkeit wie die säurekatalysierte Bromierung?
LÖSUNG:
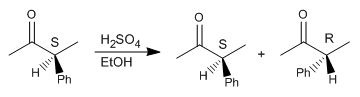
Schritt 1. Protonierung des Carbonyls
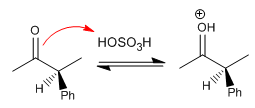
Stufe 2. Bildung des Enols (langsame Stufe)
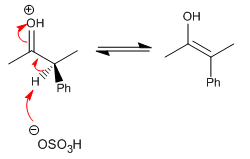
Stufe 3. Protonierung des Enols unter Bildung des Racemats
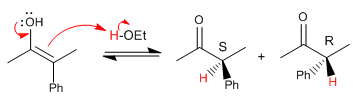
Sehen wir uns nun den Mechanismus der Halogenierung mit Brom oder Jod der Alpha-Position dieses Carbonyls an.
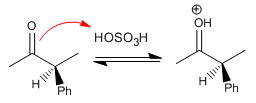
Schritt 1. Protonierung des Carbonyls
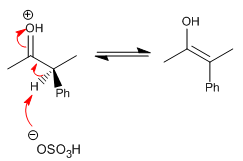
Stufe 2. Bildung des Enols (langsame Stufe)
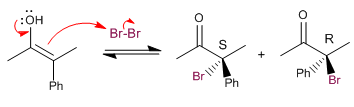
Stufe 3. Nucleophiler Angriff des Enols auf das Brom
Racemisierung und Halogenierung stellen den gleichen langsamen Schritt dar (Enolbildung), der mit der gleichen Geschwindigkeit stattfindet.









