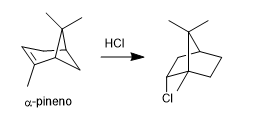
REACCIONES EN QUÍMICA ORGÁNICA
Las reacciones orgánicas permiten la transformación de unas sustancias en otras y su conocimiento es vital en la síntesis de compuestos orgánicos. En esta sección se recopilan las reacciones orgánicas más importantes, ordenadas alfabéticamente.
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 28846
Los aldehídos, sin hidrógenos alfa, dan la reacción de Cannizzaro por tratamiento con una base fuerte (NaOH)
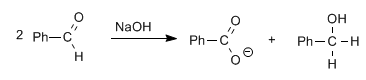
En esta reacción una molécula es reducida a alcohol, mientras que la otra es oxidada a ácido carboxílico.
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 15897
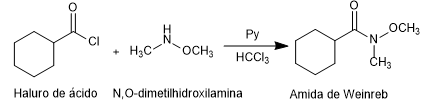
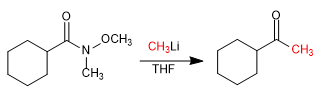
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 13731
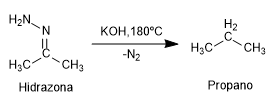
La reacción de Chugaev permite la formación de olefinas a partir de xantantos.
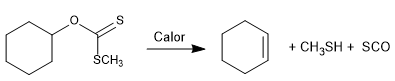
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 8912
La fragmentación de Wharton es una reacción concertada en la que un grupo saliente se sitúa en posición 4 con respecto a un grupo donor de electrones. La cesión de los pares libres del grupo donor produce la fragmentación del enlace vecino y la pérdida del grupo saliente con formación de dobles enlaces. Veamos un ejemplo:
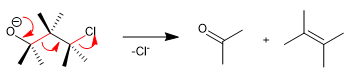
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 20837
La condensación de claisen supone la reacción de ésteres [1 ] en medio básico formando 3-cetoésteres [2 ]
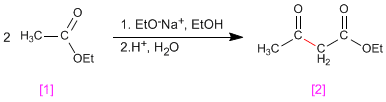
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 8048
La síntesis de Wharton permite transformar $\alpha,\beta$-epoxicetonas en alcoholes alílicos por tratamiento con hidrazina en medio ácido acético o hidrato de hidrazina seguido de base fuerte. La $\alpha,\beta$-epoxicetona se obtiene a partir de la cetona $\alpha,\beta$-insaturada por oxidación con agua oxigenada en medio básico.
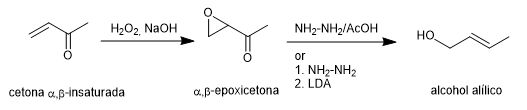
Leer más: Wharton síntesis de olefinas (Transposición de Wharton)
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 2553
Es la reacción entre un haluro insaturado de arilo o vinilo y un alqueno deficiente en electrones, como el acrilonitrilo o el acrilato de metilo. Emplea Paladio(0) como catalizador en presencia de una base que lo regenera.
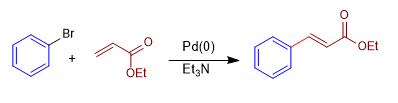
Mecanismo:
La reacción de Heck transcurre a través de un ciclo catalítico que consta de las siguientes etapas:
Etapa 1. Adición oxidante, es la etapa en la que el paladio se inserta en el enlace carbono-bromo.
Etapa 2. Carbopaladación, ataque del organometálico de paladio al carbono beta del éster a,b-insaturado.
Etapa 3. b-eliminación, formación de un doble enlace por cesión del par del enlace carbono-paladio con perdida de hidruro.
Etapa 4. Eliminación reductora, la presencia de un medio básico permite regenerar el paladio(0).
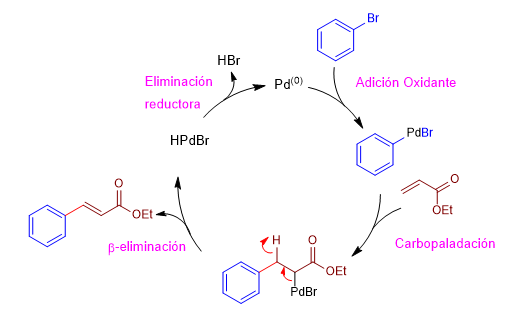
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 8780
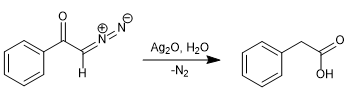
En 1902, Wolff observó que al tratar diazoacetofenona ($\alpha$-diazocetona) con Ag2O/H2O se producía un reagrupamiento que generaba el ácido fenilacético.
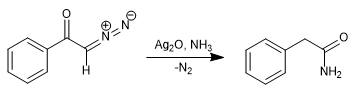
Al reemplazar el agua por amoniaco se obtiene la fenilacetamida.
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 36175
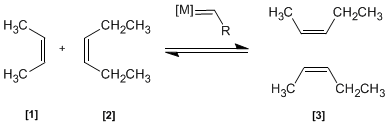
En esta reacción dos alquenos [1 ] y [2 ] son tratados con un metal de transición que actúa como catalizador, dando una mezcla de alquenos [3 ] (incluyendo isómeros Z/E). Este productos se obtiene por intercambio de grupos alquilideno.
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 19376
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 24393
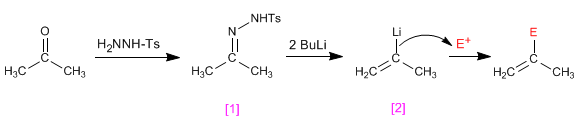
Las tosilhidrazonas de aldehidos o cetonas [1 ] reaccionan con dos equivalentes de organolíco generando un intermedio aniónico [2 ] capaz de sufrir procesos de alquilación.
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 30813
En 1855, Wurtz trató haluros de alquilo con sodio metal obteniendo el correspondiente alcano simétrico. El acoplamiento de dos carbonos sp3 pertenecientes a haluros de alquilo o arilo por tratamiento con sodio metal se conoce como síntesis de Wurtz. Por otro lado, el acoplamiento de un haluro de alquilo con un haluro de arilo se denomina reacción de Wurtz-Fittig.
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 15546
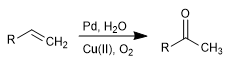
La oxidación de Wacker permite transformar alquenos en las correspondientes cetonas por tratamiento con Pd en presencia de sales de cobre. El cobre tiene la capacidad de oxidar el paladio(0) a paladio(II), siendo este último el ajente catalítico de la reacción.
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 12115
- Detalles
- Germán Fernández
- REACCIONES EN QUÍMICA ORGÁNICA
- Visto: 13929