En el propano existen dos tipos de hidrógenos no equivalentes que pueden ser sustituidos por el halógeno, obteniéndose 1-cloropropano y 2-cloropropano.
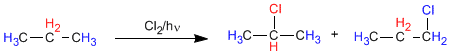
La proporción en que se obtienen estos productos depende de dos factores: número de hidrógenos que hay para sustituir por halógeno y estabilidad del radical formado.
Número de hidrógenos
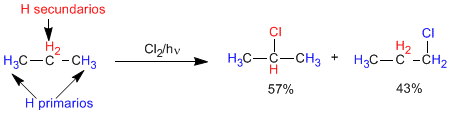
Como el propano tiene 6 hidrógenos primarios y 2 secundarios, la proporción de productos debería ser 3 a 1.
Estabilidad de radicales
Sin embargo, los enlaces C-H secundarios son más débiles que los primarios y la sustracción de un hidrógeno secundario por parte del radical cloro es mas rápida que la de un primario (aproximadamente 4 veces más rápida). Estas diferencias en la velocidad de sustracción son debidas a la mayor estabilidad del radical secundario sobre el primario. Estos datos nos permiten calcular la proporción en la que se obtienen ambos productos.
Velocidades relativas
F(1 : 1,2 : 1,4), Cl(1 : 4 : 5), Br(1 : 250 : 6300). El primer número indica la velocidad con la que se sustituye un hidrógeno primario por el halógeno correspondiente. El segundo valor nos indica la velocidad de sustitución de un hidrógeno secundario por halógeno. El tercer valor se aplica a hidrógenos terciarios.
Selectividad y reactividad
Cuanto mas reactivo es el halógeno, menos distingue entre hidrógenos primarios, secundarios o terciarios. El flúor halogena casi por igual los tres tipos de hidrógenos y se dice que es poco selectivo. Por el contrario el bromo es muy poco reactivo y busca los hidrógenos más fáciles de arrancar, (los terciarios) y los sustituye 6300 veces más rápido que los primarios. Se dice de él que es muy selectivo.
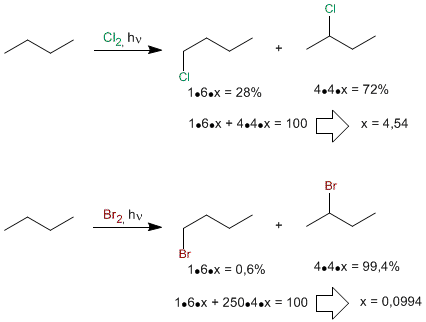
La baja reactividad del bromo hace que tenga una elevada selectividad, halogenando de forma muy mayoritaria la posición secundaria frente a la primaria. como puede observarse el cloro es mucho menos selectivo.