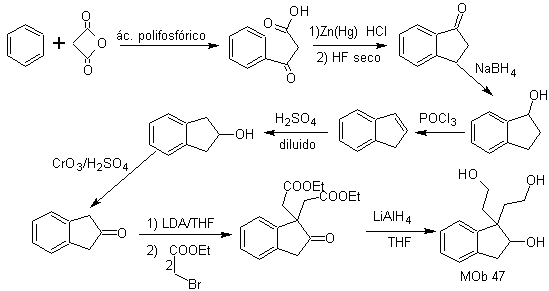
Otras estrategias de síntesis
que utilizan sintones “ilógicos”
1.
Adición de triple enlace
La estrategia de "adicionar" un triple enlace, entre
dos funciones oxigenadas en posición 1,4, permite trabajar posteriormente con una desconexión
basada en la química de los acetiluros. Con el fín de ejemplificar esta estrategia, veamos la e laboración de un plan de
síntesis para
MOb.
40. Análisis
retrosintético. Una primera IGF en
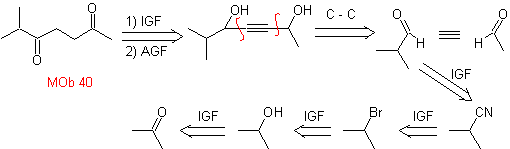
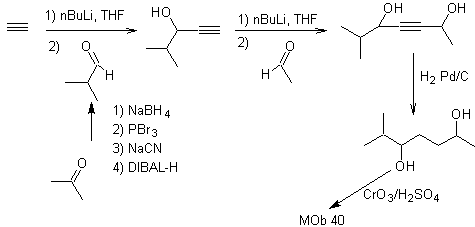
Síntesis. El diacetiluro o
acetiluro por etapas, se combina con moléculas de aldehídos diferentes, se hidrogenan la
molécula intermedia formada y seguidamente se oxida los alcoholes de la misma
al compuesto dicetónico Mob 40.
Las γ-lactonas, pueden también prepararse de manera análoga,
como se muestra a continuación:

2.
Adición del grupo COOR como grupo
activante
La adición del grupo COOR, además de activar el sintón
aniónico, facilita la desconexión de una molécula 1,4 diX.
|
Sintetizar |
|
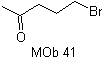
MOb 41. Análisis retrosintético.
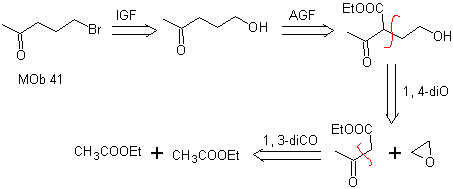
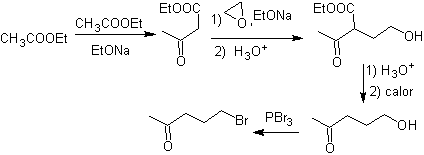
Síntesis. El acetoacetato
de etilo es un nucleófilo que abre al epóxido en medio básico.
El grupo
éster se hidroliza y descarboxila para llegar a
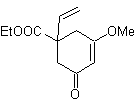
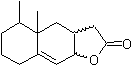
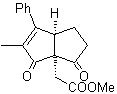
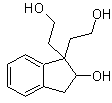
Proponer un plan de síntesis para las siguientes moléculas:
|
|
MOb 42
|
|
MOb 43
|
|
MOb 44
|
|
MOb 45
|
|
MOb 46
|
|
MOb 47
|
MOb 42. Análisis retrosintético. La desconexión 1,3-diO de
|
Oxidación de Wacker: |
|
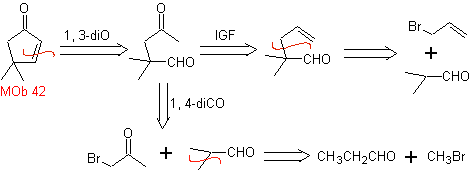
Síntesis. El bromuro de alilo alquila el aldehído, el
producto se oxida y luego se cicla en medio básico, para formar
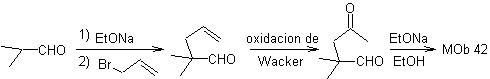
MOb 43, Análisis retrosintético. La lactona, MOb 43, se abre, para originar un
γ-hidroxiácido, que por IGFs, llega a un 1,4-cetoéster, que se desconecta conforme
al modelo.
La
ciclohexenona se forma por la anelación de Robinsón y la 1,5- diCO se prepara a
partir de la reacción de Michael.
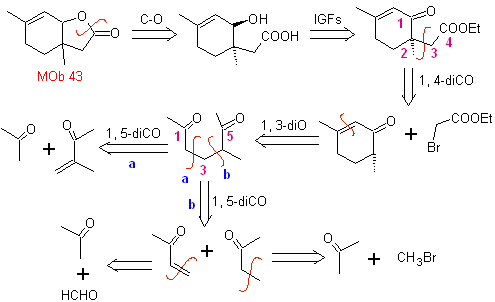
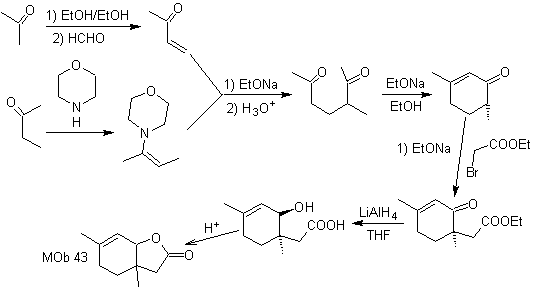
Síntesis. La enamina con
carbono secundario, se obtiene utilizando una amina secundaria voluminosa. El
compuesto 1,5-diCO, se cicla por anelación de Robinson y luego en medio básico
se hace reaccionar con el α bromo éster. El compuesto dicetónico resultante se
reduce con LiAlH4 y luego en medio ácido se forma la lactona MOb 43
MOb 44. Análisis retrosintético. El primer IGF de
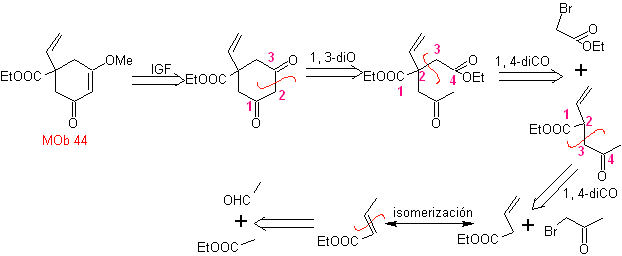
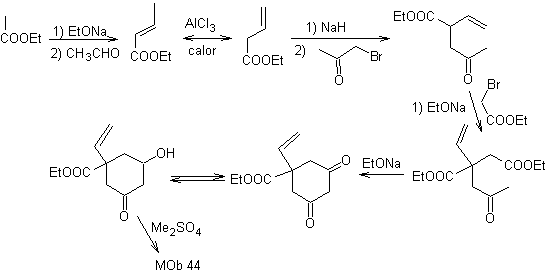
Síntesis. Es una secuencia
de condensaciones del tipo aldólico o la de Claisen. Para llegar a sintetizar
MOb
45. Análisis
retrosintético: La desconexión de la función lactona de
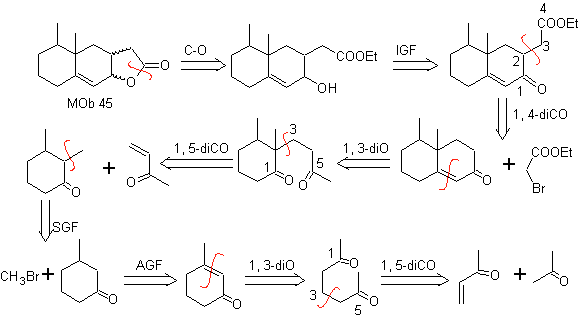
Síntesis:
Todas las reacciones utilizadas, están vinculadas a la condensación de Michael,
anelación de Robinson y la reacción de formación de ésteres de Fischer, permite
obtener la lactona, es decir
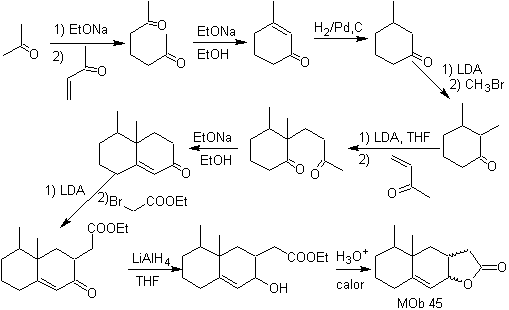
MOb
46. Análisis retrosintético.. Se sigue la desconexión 1,4-diCO, porque permite dividir
en dos partes
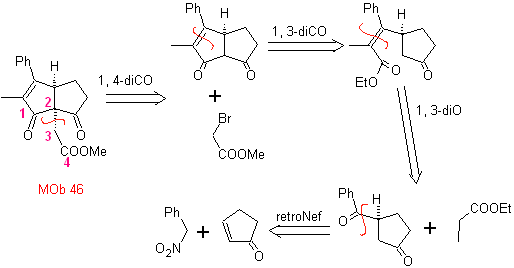
Síntesis.
El nucleófilo del nitroareno, se adiciona según Michael a la ciclopentanona
α,β-insaturada. El grupo nitro se transforma en C=O, por la reacción de Nef. El
compuesto dicarbonilico se hace reaccionar con el enolato del propanoato de
etilo, se sigue con la reacción de Dieckmann,
y las reacciones necesarias para llegar a
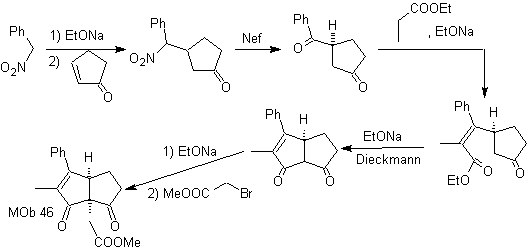
MOb 47. Análisis retrosintético.
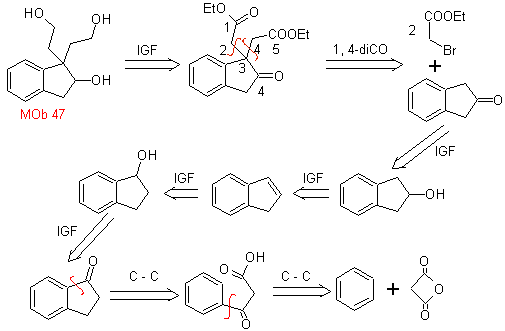
Síntesis. La
síntesis de