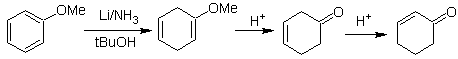Formación de enoles y enolatos
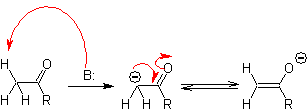
El carbono alfa de
compuestos que contienen el grupo carbonilo (aldehídos, cetonas, ésteres,
dicetonas, diésteres, nitratos, nitrilos, etc.), es el centro de muchas
reacciones de formación de enlace C-C. Debido a la acidez de los Ha, éstos sufren una a-desprotonación en presencia de una
base adecuada, con la consiguiente formación de un carbanión. La carga negativa
resultante sobre el Ca al C=O, es
estabilizada por resonancia, por el mismo grupo carbonilo.
La selección de la base, para la formación de enolatos, se
sujeta a que el pKa del ácido conjugado de la base debe ser mayor por lo menos
en tres unidades al pKa del compuesto carbonílico que posee Ha acídicos.
|
|
pKa = 20 |
MeO- pKa
= 15 |
Formación del enolato desfavorable |
|
|
pKa = 10 |
tBuO- pKa =
19 |
Formación del enolato muy favorable |
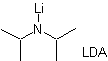
Formación de enolatos:
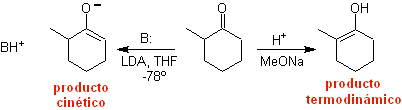
¨ El enolato cinético
|
Se da
porque el sustrato, cuenta con Hα, fácilmente accesibles para la desprotonación por medio de
una base típica como es el LDA (pKa
aprox 30)
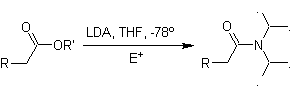
El LDA (diisopropilamiduro de litio) es una base fuerte, no
nucleofílica, con impedimento estérico |
|
¨
Enolatos de
ésteres:
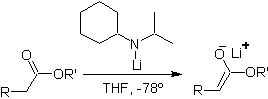
Los ésteres son susceptibles de una reacción de sustitución
por la base, el LDA puede ser
problemático, razón por la cual con los ésteres se utiliza la base no
nucleofílica (isopropilciclohexil amiduro de litio)
¨
Enolato
termodinámico:
Una desprotonación reversible puede conducir a enolatos más
estables, lo cual ocurre cuando se obtiene el C=C más substituido de la forma
enólica.
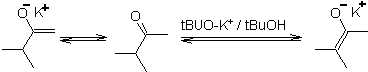
Las condiciones típicas para formar enolatos termodinámicos
son: RO-M+ en ROH como solvente prótico (pKa del ROH = 15 a18).
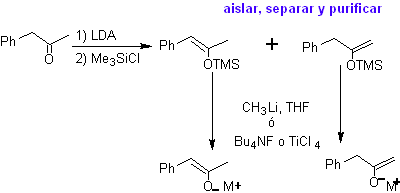
Los enolatos cinético y termodinámico, pueden ser atrapados,
aislados, separados y purificados, para obtener enolatos regioquímicamente
puros. Esto puede realizarse por la formación de acetatos de enol y
sililenoléter
¨ Acetato de enol:
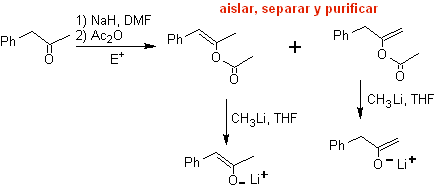
¨
Sililenoléter:
¨
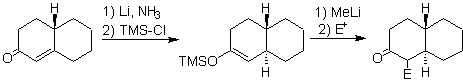
Enolatos a partir
de enonas:
El enolato se genera por reducción a partir de la disolución
de un metal en amoniaco líquido.
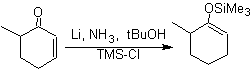
¨ Enolatos a partir de adición conjugada (1,4) en
compuestos a,b – insaturado cetónicos
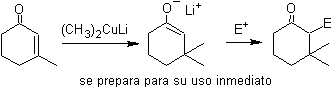
¨ Enolatos a partir de reducción de a-halocarbonilos
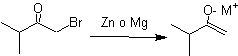
¨
Enolatos a partir
de a, b insaturado cetonas
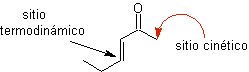
Equivalentes sintéticos
La formación de los equivalentes sintéticos del enol
señalados, transcurre a través de reacciones simples y de rendimiento alto:
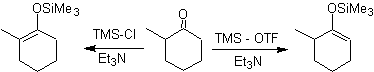
![]() Formación de los
silil enol éteres:
Formación de los
silil enol éteres:
Los derivados del silil enol, también pueden prepararse
fácilmente a partir de ésteres y amidas.
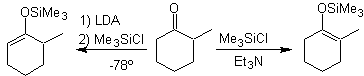
Los silil enol éteres tienen que emplearse preferentemente en
el caso de aldehídos, puesto que éstos enolizan con bases fuertes induciéndose
a la condensación aldólica.
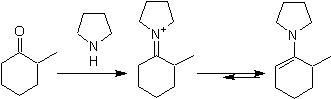
![]() Formación de
enaminas:
Formación de
enaminas:
La
regioselectividad, puede controlarse por la combinación adecuada de los efectos
electrónicos y estéricos
![]() Formación de enol
éteres por reducción de Birch:
Formación de enol
éteres por reducción de Birch:
La regioselectividad de la reducción es controlada por
efectos electrónicos