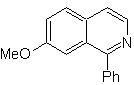
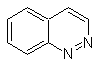
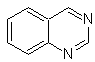
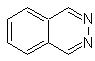
SÍNTESIS ORGÁNICA
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 27330
SÍNTESIS DE HETEROCICLOS POR CICLACIÓN INTRAMOLECULAR
La construcción de sistemas heterocíclicos también utiliza estas mismas
reacciones, con la particularidad de que en el sistema heterocíclico debe estar
presente o contener al menos un átomo diferente al carbono. Los más comunes son
el nitrógeno, oxigeno, azufre y fósforo.
El sistema cíclico de la molécula que se desea sintetizar, puede
provenir de la modificación de un sistema cíclico presente en alguno de los
reactivos implicados en la síntesis o ser el resultado de la ciclación de
antecedentes no cíclicos y que ha sido construido en el desarrollo de la
síntesis por ciclación intramolecular o por métodos basados en ciclaciones
intermoleculares (cicloadiciones).
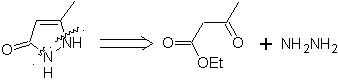
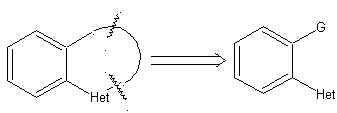
1. Ciclación intramolecular
Las reglas generales de desconexión de heterociclos provenientes de una
ciclación intramolecular, fueron adecuadamente sistematizadas por J. I. Borrell[1],
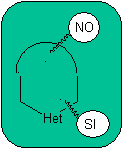
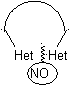
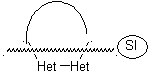
las mismas que se asumen en la presente sección (Het = N, O, S)
1.
En la síntesis de un compuesto monociclico, el cierre del
anillo supone generalmente la formación de un enlace carbono- heteroátomo.
|
Modelo:
|
|
|
Ejemplo: |
|
|
|
|
|
|
Ejemplo:
|
|
|
Modelo:
|
|
|
Ejemplo:
|
|
[1] BORRELL J.I. “Introducción
al Análisis Retrosintético”. Cap. 8.Laboratori de Sintesi. Grup
d’Enginyería Molecular (GEM). Institut Químic de Sarriá, Universitat Ramon
Llull. España. (Diapositivas de apoyo para Clases)
Leer más: Síntesis de heterociclos por ciclación intramolecular
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 36100
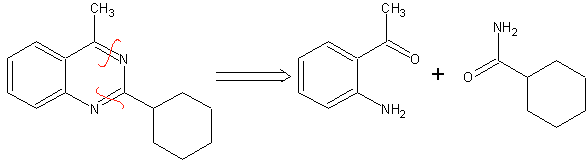
SÍNTESIS DE ANESTÉSICOS GENERALES
Los fármacos que provocan un estado reversible de depresión del Sistema Nervioso Central (SNC) caracterizado por la pérdida de sensibilidad y de conciencia, así como de la actividad refleja y de la motilidad, se denominan anestésicos generales.
Estos pueden ser gaseosos inhalables como el óxido nitroso, ciclopropano y líquidos volátiles como los éteres simples, éteres halogenados, hidrocarburos halogenados como el halotano o sólidos solubles aplicables por vía intravenosa o muscular, tales como los barbituratos y derivados del ácido fenoxiacético, derivados de la ciclohexilamina, derivados del imidazol y derivados del 5-alfa-pregnano.
1. BARBITÚRICOS
Los barbitúricos, son productos sintéticos que derivan del ácido barbitúrico obtenido por Bayer en 1863. El primer barbitúrico introducido en terapeútica a principios del siglo XX, fue el barbital.
Los barbitúricos, se clasifican por la duración de la acción, sobre el organismo en:
· De acción prolongada: Barbital, fenobarbital, mefobarbital
· De acción intermedia: Butalbital, amobarbital, alobarbital
· De acción corta: Pentobarbital, secobarbital, hexobarbital
· De acción ultracorta: Tiopental, tialbarbital
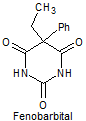
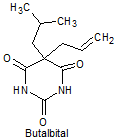
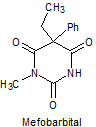
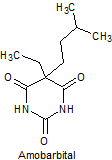
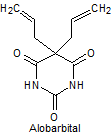
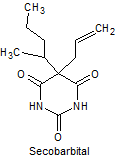
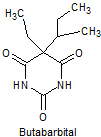
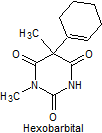
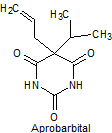
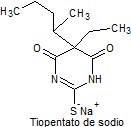
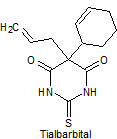
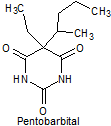
Síntesis de barbituratos:
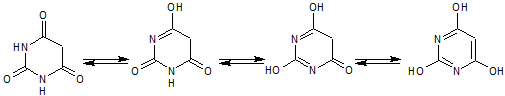
Las sales del ácido barbitúrico y sus derivados, han sido utilizados como somníferos desde los primeros años del pasado siglo. El ácido barbitúrico, es un derivado de la hexahidropirimidina, que se encuentra en varias formas tautoméras y se forma a partir del malonato de dietilo y la úrea.
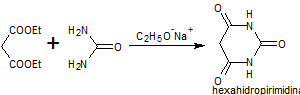
Las formas tautómeras que presenta este ácido, pueden observarse a continuació
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 23288
MOb: 75  |
MOb: 76 |
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 39189
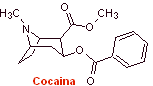
Síntesis de anestésicos locales
derivados del ácido benzoico
|
Las propiedades de los alcaloides aislados de las hojas de
la planta de coca, fueron descubiertas por vez primera por Gaediche
en 1855, la purificación y aislamiento del principio activo denominado
cocaína por Albert Nieman en 1860, prácticamente dio inició a la historia
de los anestésicos locales. Posteriormente, Einhorn introdujo en
1904 la procaína (novocaína) como anestésico local en la medicina. |
|
A partir
de entonces, la humanidad ha asistido a un desarrollo continuo y sostenido de
la síntesis de nuevas moléculas con principios activos anestésicos:
![]() En 1925 Niescher sintetizó la nupercaína.
En 1925 Niescher sintetizó la nupercaína.
![]() En 1928 Von Eisleb la tetracaína
(pantocaína) y
En 1928 Von Eisleb la tetracaína
(pantocaína) y
![]() En 1946 Lofgren y Lundquist sintetizaron la
lognicaína (xylocaína o lidocaina)
En 1946 Lofgren y Lundquist sintetizaron la
lognicaína (xylocaína o lidocaina)
![]() Luego en 1954 Af Ekenstam y Egner
obtuvieron la síntesis de la mepivacaína (scandicaína).
Luego en 1954 Af Ekenstam y Egner
obtuvieron la síntesis de la mepivacaína (scandicaína).
![]() Posteriormente en 1960 y 1964 se
introdujeron en
Posteriormente en 1960 y 1964 se
introdujeron en
![]() Por último, los siguientes años han sido
incorporados nuevos anestésicos a la medicina
Por último, los siguientes años han sido
incorporados nuevos anestésicos a la medicina
Los anestésicos
locales, son los fármacos que al ser aplicados en alguna determinada zona
del organismo, producen en la misma la pérdida temporal y reversible de la
sensibilidad (térmica, dolorosa y tactíl), sin inhibición de la conciencia del
paciente. El tiempo de duración del
efecto del fármaco depende de la dosis utilizada, de su estructura química, de
la formulación y de la forma farmacéutica del medicamento.
En general, los fármacos anestésicos locales
responden a diferentes estructuras químicas, pero todos ellos con efectos
similares o intensidades diferentes del efecto anestésico. Sin embargo se puede
hacer un intento de agruparlos en esteres del ácido benzoico, esteres del ácido
aminobenzoico, Amidas, etc.
1. Estructura química de los anestésicos locales
Loa
anestésicos locales, predominantemente son bases débiles y están formados por
un grupo areno, éster o amida, que le
confiere a la molécula propiedades lipofílicas (que determinan principalmente
la potencia del fármaco), un grupo amino terciario alifático (alquílico o
alicíclico), que proporciona a la molécula su carácter hidrofílico y una cadena
intermedia alquílica que une las partes del areno con la amina y es la
responsable del nivel de toxicidad del
fármaco.
Así,
los principales anestésicos locales utilizados en las diferentes disciplinas
médicas, se pueden encontrar en los siguientes grupos:
a)
Ésteres amínicos del acido benzoico:
b)
Esteres del ácido m-aminobenzoico:
c)
Esteres del ácido p-aminobenzoico:
d) Amidas:
e)
Cetonas:
f)
Otros grupos
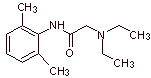
2. Síntesis de Anestésicos locales derivados de ésteres amínicos
del ácido benzoico
Los
fármacos más representativos de este grupo, son la cocaina, hexilcaína,
piperocaína, aminobenzoato de etilo, meprilcaína, amilocaína, ciclometicaína y
propanocaína. Estos nombres responden a
Leer más: Síntesis de Anestésicos Locales derivados del ácido benzoico
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 28578
Síntesis de heterociclos con varios heteroátomos
Los compuestos heterocíclicos como ya se tiene dicho
poseen una amplia gama de aplicaciones: predominan entre los compuestos usados
como farmacéuticos, agroquímicos y de uso veterinario; se utilizan como aditivos
abrillantadores, antioxidantes, inhibidores de la corrosión, como colorantes y
pigmentos; y en muchas aplicaciones más.
Por lo tanto es razonable, que actualmente gran parte
de las investigaciones en química traten de la síntesis y propiedades de los
compuestos heterocíclicos. A ese fin se orienta este artículo que pretende
proporcionar a los estudiantes de química herramientas básicas de la
retrosíntesis.
El proceso de desconexión para moléculas con varios
heteroátomos, puede realizarse para cada enlace carbono-heteroátomos, de
acuerdo a los modelos anteriormente estudiados o simultáneamente, para lo cual
se utilizan reactivos poliheteroatómicos asequibles.
1. Heteroátomos a distancia (1, 2)
Los reactivos más representativos y usuales son, las hidrazinas
e hidrazinas sustituidas, así como la hidroxilaminas.
|
Hidracina |
Hidroxilamina |
Proponer un diseño de síntesis, a partir de materiales simples, para las
siguientes moléculas:
|
|
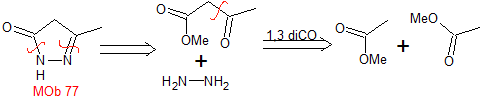
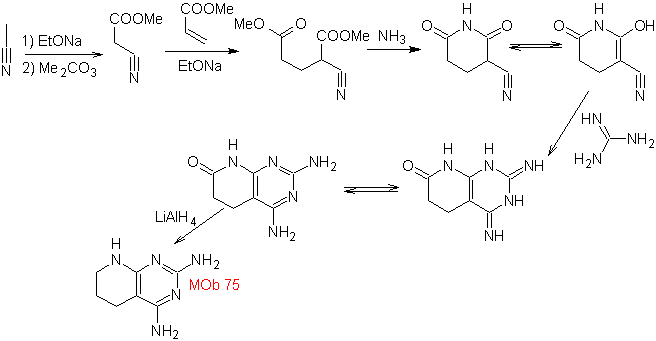
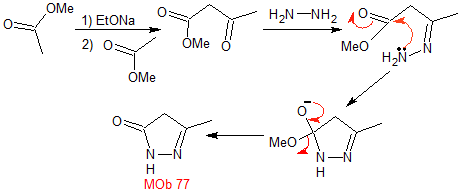
MOb 77
pirazoles |
|
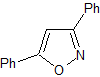
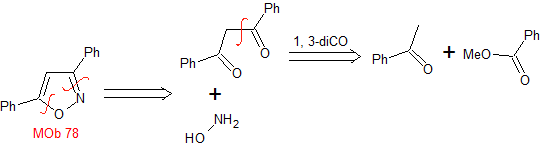
MOb 78
isoxazoles |
|
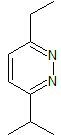
MOb 79
piridacinas |
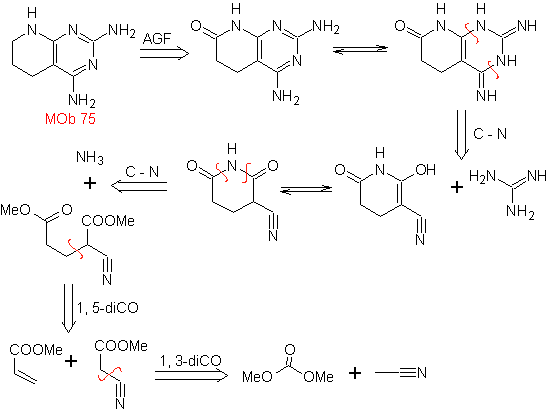
MOb 77. Análisis retrosintético. La MOb es un
derivado del pirazol y se desconecta directamente por los enlaces C-N, para
generar precursores simples como la hidracina y un compuesto 1,3-diCO.
|
|
|
Síntesis. El acetato de metilo, es un buen precursor para
formar el compuesto 1,3-diCO, el cual se combina con la hidrazina para
generar la MOb 77. |
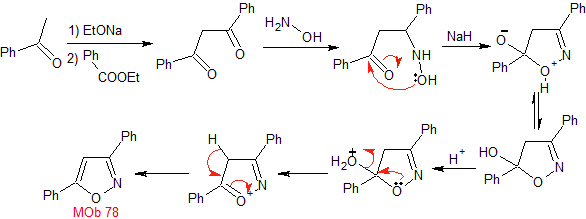
MOb 78- Análisis retrosintético.
|
|
Síntesis. La bezofenona y
el benzoato de etilo permiten formar el 1,3-diCO requerido, para reaccionar en
medio ligeramente ácido con la hidroxilamina y luego de agregar el NaH, se da
la ciclación, que requiere de mayor ácido para
deshidratar y producir finalmente
|
|
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 42384
Síntesis de anestésicos
locales derivados del ácido aminobenzoico
Anestésicos locales derivados del ácido m-aminobenzoico
Los
fármacos más representativos de este grupo, son
|
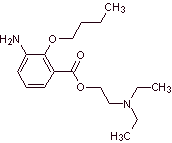
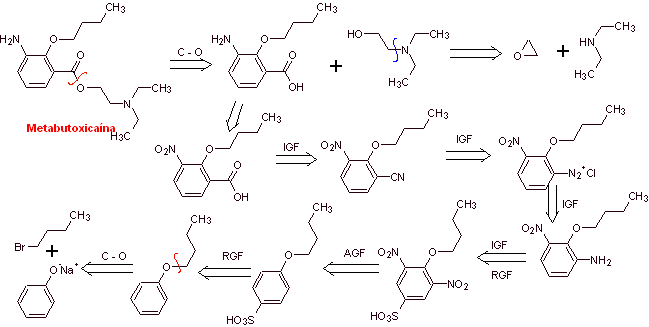
MOb 07: La metabutoxicaina,
comercializada bajo el nombre de primacaine,
es otro anestésico local utilizado en
odontología. Proponer un diseño de síntesis, para este fármaco, partiendo de
materiales simples y asequibles
|
|
Análisis retrosintético: La desconexión acilo-oxígeno
genera un aminoalcohol desconextable a amina secundaria y epóxido; el otro
precursor invita a preparar su grupo carboxilo por la hidrólisis de un grupo
nitrilo, que será colocado en el anillo bencénico por la reacción de Sandmeyer. La reducción selectiva de
sólo uno de los grupo nitro, se efectúa con polisulfuro de amonio o también por
Na2S.
Síntesis de
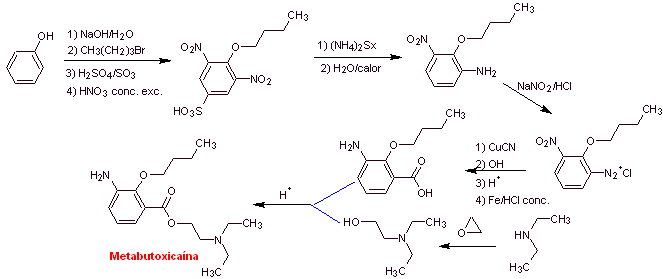
|
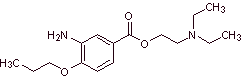
MOb 08: La proximetacaína (DCI) o proparacaína, conocido por los nombres
comerciales Alcaine, Ak-Taine, y otros, es un fármaco anestésico tópico del
grupo amino ésteres. Está indicado para su uso
como anestésico oftálmico, para reducir el dolor y el malestar en el ojo.
Proponer un diseño de síntesis para este anestésico, partiendo de materiales
simples y asequibles. |
|
Análisis retrosintético: La desconexión inicial acilo-oxígeno
de la proximetacaína, conduce nuevamente a un ácido m-aminobenzoico, con un sustituyente
alcóxido en la posición para y un aminoalcohol que se forma a partir de la
amina y epóxido correspondientes.
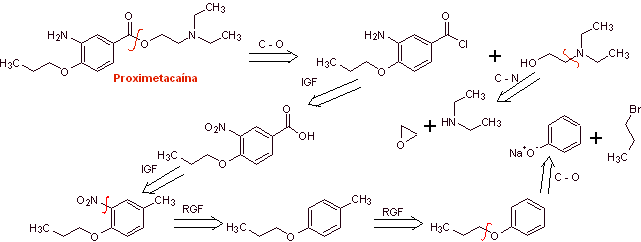
Síntesis de la proximetacaína:
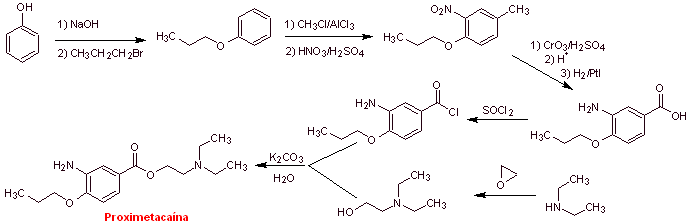
Leer más: Síntesis de Anestésicos Locales derivados del ácido aminobenzoico
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 25947
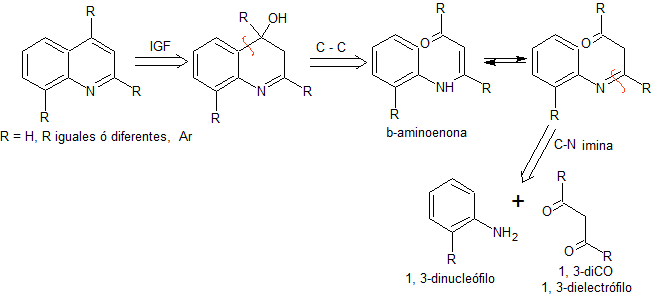
Síntesis de Quinoleínas
(Método de las
desconexiones)
|
|
Las quinoleínas
compuestos formados por núcleos derivados del benceno y piridina se
encuentran en numerosos alcaloides, en cierto tipo de colorantes y en un
considerable número de fármacos, por lo que son de gran interés comercial en
los laboratorios industriales. |
Aquí se mencionarán sólo aquellos métodos de
síntesis, que producen rendimientos aceptables en sus reacciones:
1.
Síntesis de
COMBES
En este método, inicialmente se realiza la condensación
de un compuesto 1,3-diCO con una anilina o su derivado, para formar una
β-aminoenona, que posteriormente se cicla en medio ácido concentrado al
correspondiente derivado quinolénico. En
términos retrosintéticos, la síntesis de COMBES, se expresaría del siguiente
modo:
|
|
|
Proponer un plan de síntesis para
|
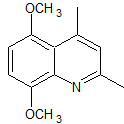
MOb 95:
|
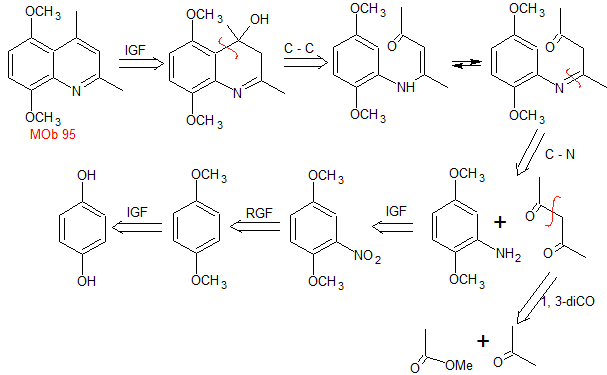
MOb. 95. Análisis retrosintético: Inicialmente se
funcionaliza la MOb, para proceder a desconectarlo, según Combes y generar de
este modo equivalentes sintéticos que conduzcan a moléculas precursoras
1,3-dinucleófilo y 1,3-dielectrófilo.
|
|
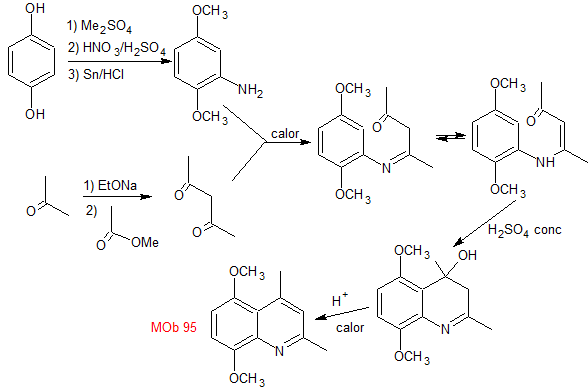
Síntesis: La hidroquinona
permite formar la 2,5-dimetoxianilina como 1.3 dinucleófilo. La condensación de la acetona y acetato de metilo, conducen a la
2,4-pentanodiona, que funciona muy bien como un 1,3-dielectrófilo. Combinadas
ambas moléculas precursoras, utilizando ácido sulfúrico concentrado para
promover la ciclación y por un calentamiento posterior se llega a formar
|
|
|
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 33951
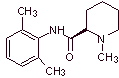
Síntesis de anestésicos locales derivados de las fenilacetamidas
Un
listado de los principales componentes de este grupo de anestésicos, se
presenta a continuación:
Lidocaina
(lignocaína, xilocaína), mepivacaina, etidocaina, articaína (carticaína),
bupivacaína, prilocaína, dibucaína (cincocaína), ropivacaína, trimecaína,
butanilicaína, clibucaína, tolicaína, trimecaína, vadocaína, oxitazaína, anidicaína, dimetisoquín,
oxetazin, pirrocaína, paramoxina, properacaína, oxetacaína.
|
MOb 19; |
|
Análisis
retrosintético:
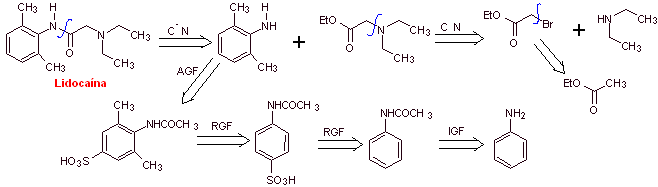
Síntesis de
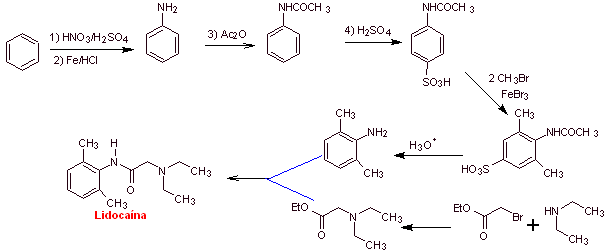
|
MOb 20: La mepivacaína
es un anestésico local del tipo amida, es de acción más rápida que la
procaína, pero su efecto anestésico es mas corta que la de la procaína. Como
la mayoría de loa anestésicos se suministra como sal de clorhidrato de
racemato. |
|
Análisis retrosintético: La desconexión inicial por el
enlace amídico, genera dos moléculas precursoras, una de las cuales, la
2,6-dimetilanilina ya fue sintetizada en
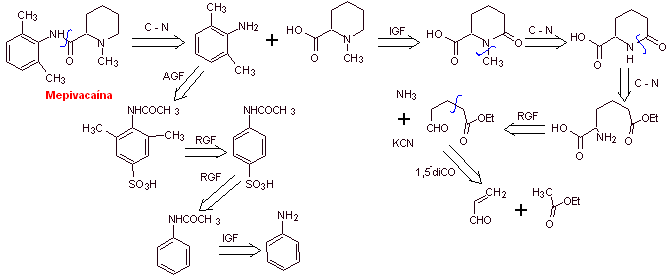
Síntesis de
la mepivacaina:
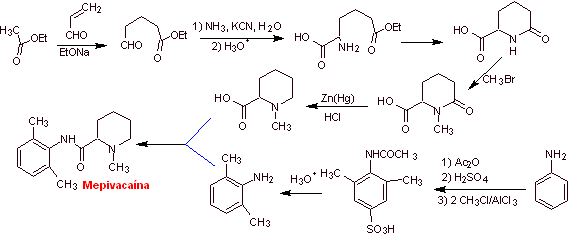
Leer más: Síntesis de Anestésicos Locales derivados de fenilacetamidas
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 21599
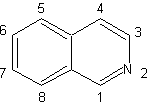
Síntesis
de Isoquinoleinas
(Por
el método de las desconexiones)
|
|
Las
isoquinoleinas difieren estructuralmente de las quinoleinas en la
posición del nitrógeno, ya que esta
última, no se encuentra fusionada, por lo que presenta una “reactividad
alifática”.
No se encuentra libre en la
naturaleza, pero el ciclo de la isoquinoleina se encuentra en algunos
alcaloides, en forma aromática o reducida, por ejemplo, la papaverina. |
Los métodos sintéticos más conocidos para la preparación de isoquinoleinas
se inician con 2-feniletilaminas y comprenden una ciclación por intermedio de
un carbono adicional proporcionado por el grupo carbonilo de otro compuesto.
Los principales métodos sintéticos son: La síntesis de Pomeranz-Fritsch, la
síntesis de Bischler-Napieralski, síntesis de Pictet-Gams y la síntesis de
Pictet-Spengler.
1. Síntesis
de POMERANZ-FRITSCH.
Este método de
síntesis de la isoquinoleina, se produce en dos etapas:
a.
En primer lugar, se condensa el benzaldehído
(1,3-electrófilo-nucleófilo) con el dietilacetal del aminoacetaldehido
(1,3-nucleófilo-electrófilo) para formar una aldimina estable.
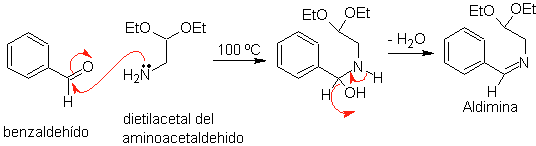
b.
Seguidamente, la aldimina cicla en un medio ácido fuerte,
a una imina, con eliminación simultánea de etanol, para producir una
isoquinoleina.
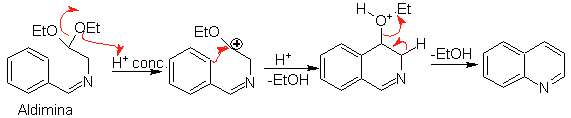
Esta segunda etapa, al ser una sustitución electrofílica, está sujeta al
efecto que tienen en dicha reacción los sustituyentes aceptores o donadores de
electrones sobre el anillo bencénico. Sin embargo, debido a la hidrólisis de la
imina formada, en el medio ácido fuerte utilizado en la reacción, reduce el
rendimiento del proceso.
Este método, permite acceder a isoquinoleinas sustituidas en el C-1, para
lo cual se han probado cetonas aromáticas, con rendimientos muy bajos. No
obstante, se ha tenido mayor éxito al utilizar la variante de las bencilaminas
adecuadamente sustituidas como 1,4-dinucleófilos y el dietilacetal del glioxal
como 1,2-dielectrólfilos
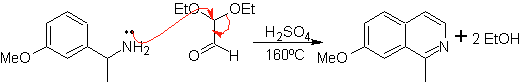
Algo que debe quedar en claro, es que el método de Pomeranz-Fritsch y su
variante, anteriormente analizada, no permiten preparar isoquinoleinas
sustituidas en el C-3 y el C-4 del heteroátomo. El análisis retrosintético de
este método, muestra los posibles intermediarios implicados en la reacción y
los materiales probables de partida.
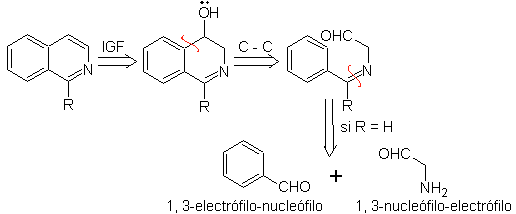
|
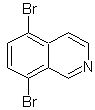
Proponer un
diseño de síntesis, para cada una de las siguientes isoquinoleinas:
|
MOb
107
|
|
MOb 108
|
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 20517
Síntesis de anestésicos locales derivados de varios grupos funcionales
Existen analgésicos, que derivándose de grupos funcionales distintos al ácido benzoico, ácido aminobenzoico o fenilacetamida, también poseen propiedades analgésicas similares a los fármacos anteriormente sintetizados. Los más representativos en este grupo son los siguientes:
Fenacaina, promocaina (pramoxina), bucricaína, cloruro de etilo, dimetisoquina, diperodón, ketocaína, mirtecaína, octacaína, diclonina (diclocaína)
|
MOb 29: La diclonina es un anestésico oral en Sucrets, una más de las pastillas de la garganta. También se encuentra en algunas variedades de spray para la garganta dolorida Cepacol. Proponer la síntesis del fármaco. |
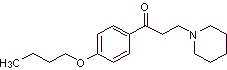 |
Análisis retrosintético: La estructura de la cetoamina, permite proponer una desconexión vinculada a la reacción de Mannich (cetona metílica + formaldehído + amina secundaria). Las desconexiones posteriores de las moléculas precursoras, están relacionadas con reacciones químicas, relativamente simples y de alto rendimiento.
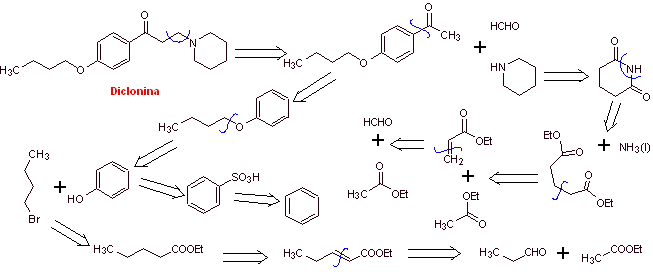
Síntesis de la diclonina:
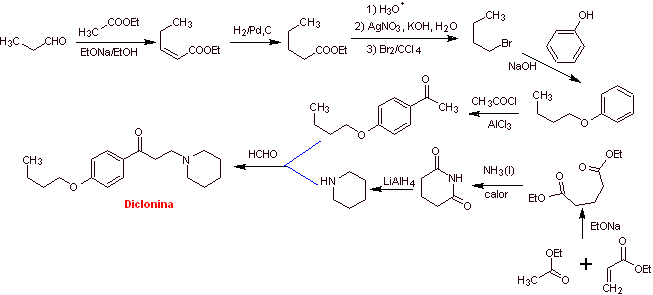
Leer más: Síntesis de Anestésicos Locales derivados de varios grupos funcionales
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 17535
Síntesis
de BENZODIAZINAS
(Por
el método de las desconexiones)
Las
estructuras de las benzodiazinas, se encuentran en muchos alcaloides, principalmente como un
sistema de anillo quinazolónico. Los otros derivados de la benzodiazina, como
las cinnolinas, quinoxalinas y ftalizinas, son también parte importante de
muchos fármacos de un espectro de uso significativo, que los hacen en general,
muy importantes dentro la síntesis orgánica y particularmente la
farmacoquímica. Así, se los puede encontrar como antiinflamatorios,
antihipertensivos, antibacterianos, analgésicos, antibióticos, etc.
|
Cinnolina |
|
Quinazolina |
|
Ftalizina |
|
Quinoxalina |
Síntesis de las Cinnolinas
De acuerdo a
la estructura que presenta la cinnolina, se tiene las siguientes opciones para
su síntesis:
![]() Síntesis de von Richter:
Síntesis de von Richter:
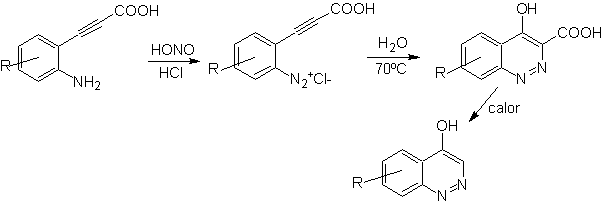
![]() Síntesis de Widman – Stoermer:
Síntesis de Widman – Stoermer:
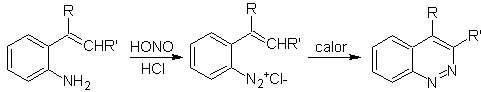
|
Proponer
un plan de síntesis para la siguiente molécula:
|
MOb 114
|
MOb 114. Análisis retrosintético.
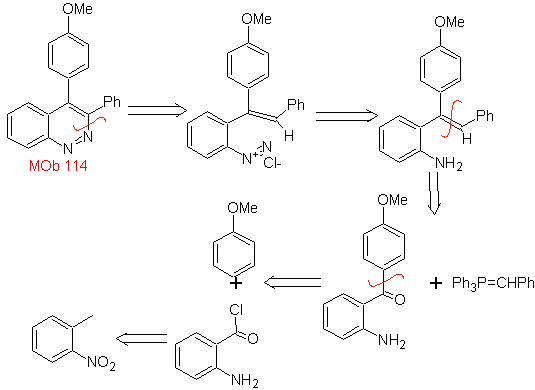
Síntesis La formación
de
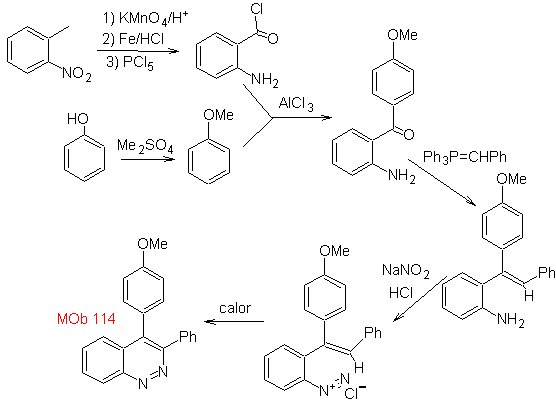
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 14568
Síntesis del poliaspartato (rootGrow)
1. Síntesis del poliaspartato (rootGrow)
2. Procedimientos de biosíntesis
Se afirma que la fórmula del rootGROW tiene relación con la del nutra-sweet
(aspartamo), un edulcorante poderoso, que está siendo retirado o ya lo fue del
mercado, debido a sus efectos nocivos en la salud de las personas.
El nutra-sweet, puede ser
sintetizado a partir de la fenilalanina, de acuerdo al esquema siguiente:
nutra sweet
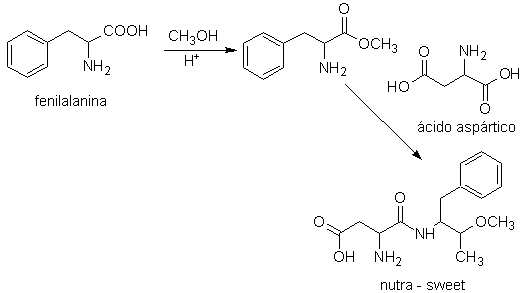
A su vez, el ácido aspártico, base fundamental, par obtener el rootGrow,
que puede ser dextrógiro (D) o levógiro (L), se prepara de acuerdo a los
siguientes esquemas de síntesis:
Esquema A: (proceso de transaminación)
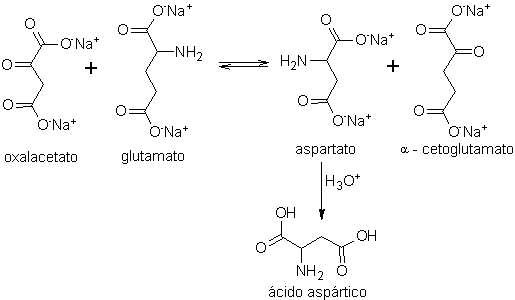
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 74867
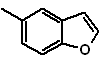
Síntesis
de INDOLES
(Por
el método de las desconexiones)
El sistema de anillos del indol se ha encontrado en muchos compuestos
naturales de gran interés químico y bioquímico, razón por la cual se afirma que es el más abundante en la naturaleza. Así, el triptófano es un
aminoácido esencial, el índigo un colorante y el ácido indolil-3-acético, una
hormona de crecimiento vegetal. Por otro lado, el interés en estas moléculas
surge de su uso farmacológico, son un ejemplo el sumatriptan (antimigrañas) y
el frovatriptan también antimigrañas.
El indol es un sólido cristalino incoloro de p.f. 52ºC, fácilmente soluble en la mayoría de los disolventes orgánicos y cristaliza en agua, tiene olor agradable y por esa razón también se lo usa como base de perfumes.
Fué preparado por primera vez en 1866 por calentamiento del oxindol con polvo de cinc y ha venido a ser un producto comercial importante. Baeyer en 1869 propuso la siguiente síntesis:
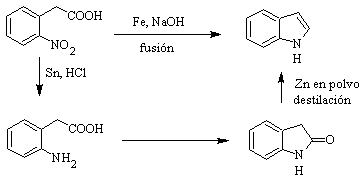
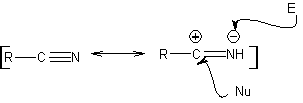
Los métodos de síntesis clásicos de indoles, son los de Fischer, Bischler,
Reissert y Leimgruber-Batcho, Bartoli, Larock, Gassman, Sugasawa, Fukuyama, Hegedus y Dobbs.
1.
Síntesis
de FISCHER
Consiste en calentar fenilhidrazonas de cetonas o aldehídos, con cloruro de
zinc anhidro, trifluoruro de boro, ácido polifosfórico, o algún otro
catalizador acido, para producir indoles. Ocurre una transposición, catalizada
por ácidos, de una fenilhidrazona con eliminación de agua y NH3. Los
grupos electrodonadores favorecen la ciclación y los electroatractores la
dificultan.
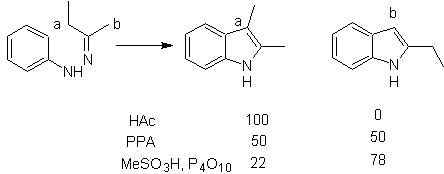
Con cetonas asimétricas, la ciclación intramolecular de la hidrazona puede
conducir a dos indoles isómeros en distintas proporciones según las condiciones
utilizadas, en medios fuertemente ácidos, puede predominar el indol menos
sustituido.
Cuando existen sustituyentes en meta, respecto al nitrógeno de la
hidrazona, la ciclación puede tener lugar en dos posiciones, que conducen a dos
indoles isómeros:
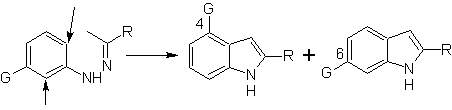
Si el sustituyente G es electroatractor, los dos isómeros (4- y 6-) se
forman aproximadamente en la misma proporción. En cambio si G es un
sustituyente electrodonador, se forma mayoritariamente el isómero sustituido en
6. El análisis retrosintético del indol formado por la síntesis de Fischer, se
puede plantear de la siguiente manera:
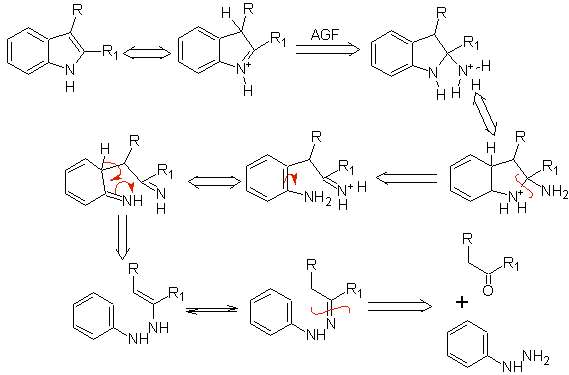
|
Proponer
un plan de síntesis para las siguientes moléculas:
|
MOb 119
|
|
MOb 120
|
MOb
119. Análisis
retrosintético. La desconexión fundamental en los indoles que se supone,
se forman por la síntesis de Fischer, corresponde a una retro-transposición,
que se muestra en la desconexión de
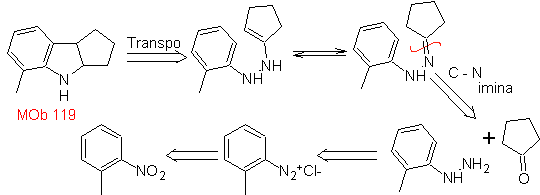
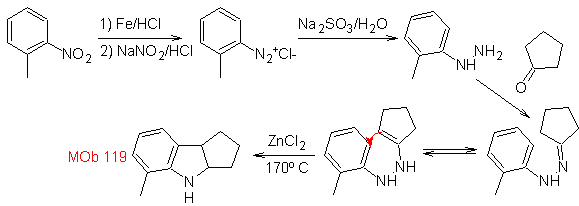
Síntesis:
A partir del orto-nitrotolueno, se genera el derivado intermedio de la
fenilhidrazina, necesaria en la síntesis de indoles de Fischer, se forma la
imina con una ciclopentanona, y por calentamiento de forma
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 29921
Síntesis de compuestos 1,3 y 1,5-dicarbonílicos
Proponer un diseño de síntesis por el método de las desconexiones (método del sintón) a partir de materiales simples y asequibles, para las siguientes moléculas:
(Recuerde que si no es posible plantear una desconexión directa, será necesario recurrir a la estrategia de funcionalizar previamente la MOb, hasta llegar a un modelo de desconexión aplicable)
SOLUCIONES A LOS PROBLEMAS PROPUESTOS
La MOb 01, no presenta ninguna relación dioxigenada, aspecto que en algún sentido es una ventaja para el químico. Esto es, la estrategia a utilizarse, permitirá buscar relaciones dioxigenadas en la molécula precursora (equivalente sintético) con cierto grado de libertad, es decir, puede postularse según la estructura de la MOb, una gama de relaciones dicarbonílicas y/ó hidroxicarbonílicas, en posiciones relativas 1,2, 1,3, 1,4, 1,5 y/o 1,6 o sus variantes, como son los compuestos α, β-insaturado carbonílicos.
En esta oportunidad, se ejercitará las síntesis, recurriendo a las relaciones 1,3 y/o 1,5 dioxigenadas. De este modo se convertirá a la molécula objetivo y precursoras en estructuras desconectable según un modelo conocido y preestablecido.
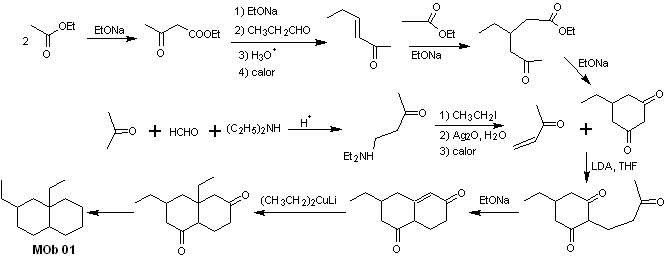
Solución MOb 01
Análisis retrosintético: En la molécula que nos ocupa, se puede empezar por realizar un AGF, colocando un grupo C=O en la estructura de la molécula precursora, en posición tal, que permita luego realizar otro AGF, con un doble enlace ubicado en el carbono alfa y beta respecto al carbonilo, para proceder a desconectarlo.
La insaturación α, β, respecto del C=O, debe buscarse como el alqueno más sustituido de las alternativas que podrían existir. La presencia de un sustituyente en la posición beta al C=O, induce a pensar que el mismo pudo adicionarse como nucleófilo a un compuesto α, β insaturado carbonílico, según la reacción de adición conjugada de Michael. En base a estas consideraciones, puede postularse el siguiente análisis retrosintético, para la MOb 01:
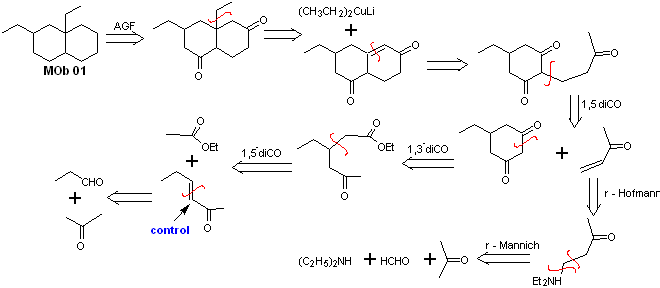
Síntesis de la MOb 01: La condensación entre un aldehído y cetona enolizables, normalmente origina productos de autocondensación o de condensación cruzada. Esto se puede evitar, recurriendo a la estrategia de ejercer control, en el nucleófilo de la cetona, como puede verse en el esquema adjunto.
Por otro lado, cuando se requiere utilizar cetonas vinílicas como sustrato en la reacción de Michael, supondría la utilización del formaldehído. Lamentablemente este aldehído al ser muy reactivo en medio básico, tiende a originar reacciones de polimerización, que bajan drásticamente el rendimiento de la síntesis, por tal razón se combina adecuadamente las reacción de Mannich y la eliminación de Hofmann, para las cetonas vinílicas con rendimientos altos.
La eliminación de Hofmann, podría llevarse acabo en el mismo medio básico que se utiliza para la reacción de Michael, por lo que no es necesario aislar la vinilcetona.
Sin embargo, debido a la experiencia aún limitada en síntesis, se postulará la utilización de un óxido de plata en medio acuoso para lograr la eliminación de la amina y formación de la vinilcetona
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 23731
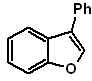
Síntesis de
Benzofuranos y Benzotiofenos
(Por
el método de las desconexiones)
1. Síntesis
de Benzofuranos
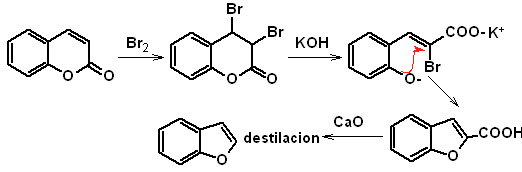
El benzofurano, usualmente llamado cumarona, es un liquido incoloro, que es aislado del
alquitrán de hulla y es mucho más estable al ataque químico que el furano.
Se hará mención y desarrollaran las síntesis más clásicas para la
preparación de benzofuranos:
a. A partir de la cumarina
b. A partir de una reacción de condensación de Claisen interna
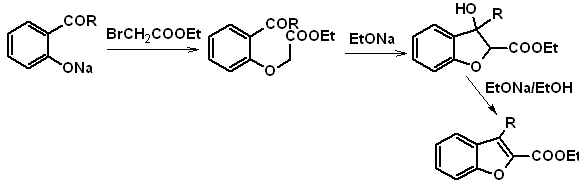
c.
A partir de una
transposición de Claisen
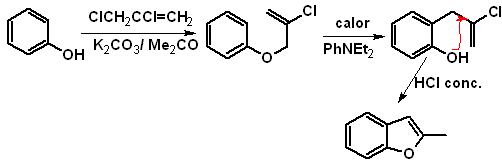
Proponer un diseño de
síntesis, para los siguientes benzofuranos:
|
: |
MOb
127
|
… |
MOb
128
|
MOb
127, Análisis
retrosintético. La estrategia de desconexión, en
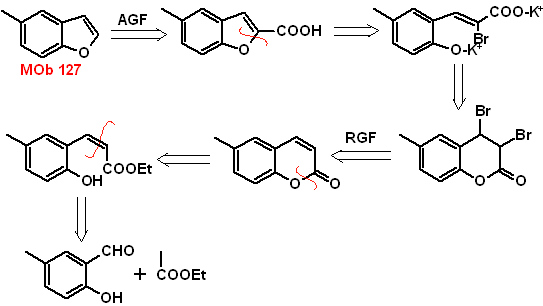
Síntesis.
El intermediario 2-hidroxi-5-metilbenzaldehido, se prepara a partir del
benceno. El derivado de la cumarina que se forma, se halogena hidroliza en sol
de KOH y posteriormente se calienta con CaO, para descarboxilar y así formar
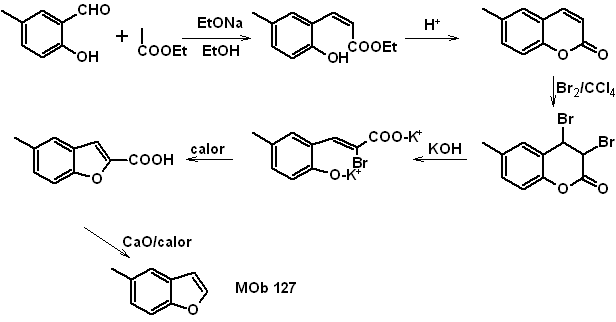
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 47451
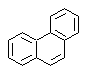
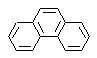
Síntesis del Fenantreno
(Método del Árbol de Síntesis)
El Fenantreno es un hidrocarburo aromático policíclico, que contiene tres anillos bencénicos fusionados, razón por la cual se constituye en un isómero del antraceno.
|
|
ó |
|
Los métodos de síntesis tradicionales del Fenantreno, aquellos que conllevan la formación de los ciclos y su posterior “aromatización”, están vinculados a los propuestos por Haworth y a Bardhan – Sengupta (1932), como se verá a continuación.
Es posible también, proponer otros nuevos métodos, para el Fenantreno y en general para los compuestos aromáticos policíclicos, en base a la utilización adecuada de las reacciones de acoplamiento de Ullman, la reacción de Heck, la de Suzuki y la de MacMurry, así como las variantes y extensiones que presentan estas reacciones.
a) Síntesis de Haworth:
Este método, se basa en la reacción de acilación de Friedel – Crafts y presenta el inconveniente de que la ciclación final, para formar el tercer anillo fusionado al naftaleno, no es selectiva, debido a que también, es posible que el cierre se produzca en el otro carbono adyacente al grupo que contiene la función carboxílica y forme de este modo un isómero, que por las condiciones de reacción resulta ser el minoritario.
Método A:
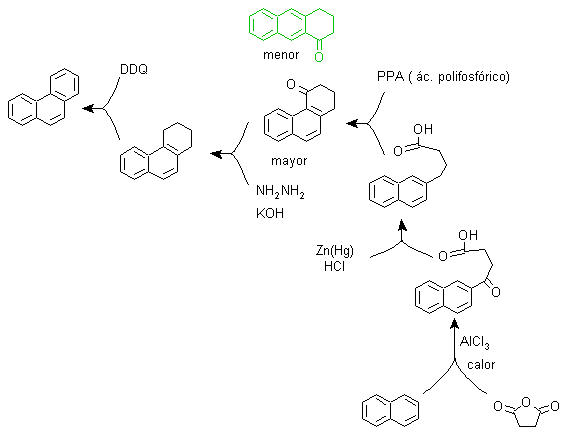
Los materiales de partida, suelen ser el naftaleno y el anhídrido succínico. Para garantizar que la reacción de acilación con el anhídrido ocurra en el carbono 2 (beta) del naftaleno, es necesario realizar la reacción a una temperatura superior a los 60 ºC.
A temperatura ambiente, la posición de acilación será el carbono 1 (alfa), lo cual origina una variante al método, que sin embargo esencialmente son las mismas reacciones que ocurren y también existe la formación de otro isómero que es mucho menos significativo que en el primer caso. Por lo cual es preferiblemente utilizado como la reacción oficial de preparación del Fenantreno por el método de Howorth.
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 54821
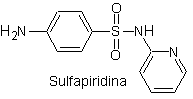
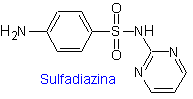
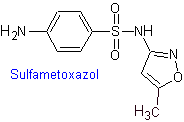
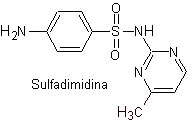
SÍNTESIS DE SULFAMIDAS
Se conoce que las sulfonamidas fueron los primeros antimicrobianos en ser utilizados en forma
sistémica. Su estructura química es un núcleo de benceno con grupos amino que
le brindan su actividad. El grupo amino es acetilado en el hígado inactivándolo.
Según el sustituyente en dicho sector el fármaco es más activo.
Dada
su semejanza con el ácido para-aminobenzoico se comporta como inhibidor
competitivo de esta sustancia que es necesaria junto a la dihidropteridina para
sintetizar el ácido dihidrofólico compuesto intermediario de la vía de síntesis
de los folatos.
Las
bacterias a diferencia de organismos más avanzados requieren sintetizar sus
propios folatos [no lo adquieren del ambiente], entonces las sulfonamidas al
inhibir este proceso inhiben los procesos de síntesis de ácidos nucléicos y son
BACTERIOSTÁTICOS.
|
TRIMETROPRIM
El Trimetroprim es un derivado de la 2,4
diaminopirimidinas tal como |
Este compuesto INHIBE a la enzima dihidrofolato reductasa e
impide que se forme el ácido tetrahidrofólico, es decir actúan en la misma
vía metabólica que las sulfonamidas, pero en una reacción enzimática
posterior.
El trimetroprim nunca se utiliza solo, mas cuando se asocia a
sulfonamidas se potencian de tal forma que se hacen BACTERICIDAS, disminuyen
la posibilidad de generar resistencia y aumentan el espectro antimicrobiano.
La asociación entre sulfametoxazol y trimetroprim es fija: 1:5
. Por ejemplo las preparaciones comerciales Cotrimoxazol [forte o no] vienen
con esta razón. |
Las sulfamidas, generalmente se clasifican según la duración
de su acción y la forma de cómo se aplica el medicamento, así como otras
características. Según el modo de acción, las sulfamidas pueden ser:
a)
Sulfamidas
de acción corta o intermedia.
a. Sulfamidas
de uso general
i. Sulfatiazol
ii. Sulfadiazina
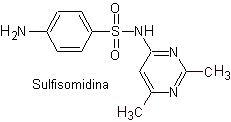
iii. Sulfadimidina
iv. Sulfametoxazol (sola
o asociada a trimetoprima: cotrimoxazol)
b. Compuestos
altamente solubles empleados inicialmente en el tratamiento de las infecciones
urinarias.
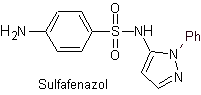
i. Sulfisoxazol
ii. Sulfametizol
iii. Sulfasomidina
b)
Sulfamidas
de acción prolongada.
iv.
Sulfametoxipiridazina
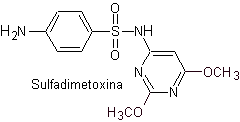
v. Sulfadimetoxina
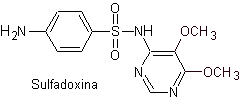
vi. Sulfadoxina
c)
Sulfamidas
limitadas al tracto gastrointestinal
vii. Sulfaguanidina
viii. Sulfatalidina
ix. Sulfasuxidina
x. Sulfazolazina
d) Sulfamidas
tópicas.
xi. Acetato de mafenida
xii. Sulfadiazina argéntica
xiii. Sulfacetamida
de sodio
Principales sulfas:
|
|
……… |
|
|
|
|
|
|
|
…….. |
|
|
|
|
|
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 87602
SÍNTESIS DE LA PIRIDINA Y SUS DERIVADOS
|
La piridina es un líquido incoloro de olor desagradable, presenta en su estructura un heterociclo de seis eslabones, y tiene un carácter aromático; le sigue en importancia a la quinoleína debido a que se encuentra presente en numerosos alcaloides y fármacos de diversos usos. |
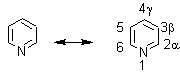 |
|
|
Es muy soluble en agua, con un pKa 5.17 de punto de ebullición 115º C y es una base débil, pKa del amoníaco 9.2 de la piperidina 11.2 y un poco más fuerte que la anilina cuyo pKa es 4.6. Normalmente se lo extrae del alquitrán de hulla conjuntamente a las metilpiridinas, denominadas picolinas. |
 |
|
1. Reacciones químicas de la piridina
La piridina debido a su alta estabilidad no es afectada con los agentes oxidantes comunes, sin embargo se reduce con mayor facilidad que el benceno, para formar la correspondiente piperidina.
Por otro lado, se puede afirmar que la reactividad de la piridina es equivalente a la de una anillo bencénico disustituido con dos grupos nitro en posición para, razón por la cual no todas las sustituciones electrofílicas aromáticas que se dan en el benceno, ocurren en la piridina. Así por ejemplo no se producen la alquilación y acilación de Friedel Crafts, tampoco ocurre la nitración a temperaturas moderadas y de la halogenación la única reacción significativa es la bromación.
Las estructuras de resonancia de la piridina que reciben (o toman) un sustituyente B electrófilo y que a continuación se muestran, permiten la predicción de los lugares en los cuales se producirán las reacciones de sustitución electrofílica:
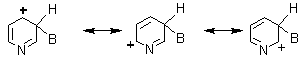
La inspección de las formas de resonancia cargadas sugiere que la densidad electrónica sobre los átomos de carbono alfa y gamma es especialmente baja; consiguientemente debe esperarse una sustitución en beta, además debido a que esta posición es la única en la que el estado de transición en la sustitución, no tiene una forma de resonancia con una carga sobre el nitrógeno trivalente.
ü Halogenación. La bromación es más estereoespecífica que la cloración, porque se puede obtener sólo el derivado monobromado en beta, separable de la dibromopiridina por destilación.
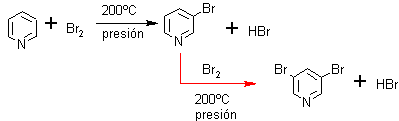
Sin embargo, también se pueden obtener derivados clorados, a partir de las alfa o gamma hidroxipiridinas
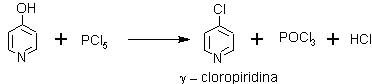
ü Sulfonación. La piridina puede sulfonarse a temperaturas altas utilizando como catalizador sulfato de vanadio, formando ácido sulfónico, con muy buenos rendimientos; importante intermedio para la síntesis de piridinas sustituidas.

2. Síntesis y reacciones de los derivados de la piridina. La química de los grupos sustituyentes en la piridina, depende de la posición de sustitución, habiéndose arribado luego de las observaciones empíricas a las siguientes generalizaciones:
a) Los grupos funcionales sustituidos en la posición beta (3 ó 5) de la piridina, presentan propiedades aromáticas características.
b) Los grupos funcionales ubicados en las posiciones alfa o gamma de la piridina (2,4 o 6) presentan reacciones características idénticas a los que están unidos al carbono alfa de los grupos carbonilo (por ejemplo acidez de los hidrógenos).
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 28052
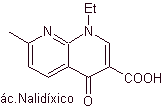
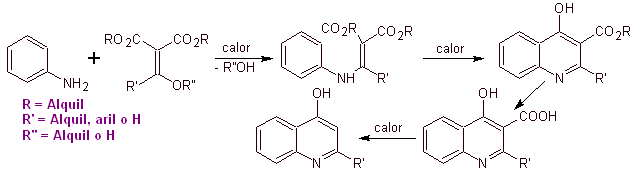
Síntesis de Antibióticos Fluoroquinolonas
Las Quinolonas pertenecen a un grupo de agentes antibacterianos
sintéticos. El agente más antiguo de esta familia, el ácido nalidíxico,
utilizada a principios de los años 60, presenta un buen espectro contra las
enterobacterias (espectro antibacteriano limitado) pero su farmacocinética no
es muy favorable para el uso rutinario en la clínica por su baja
biodisponibilidad en tejidos y su vida media corta.
Por esta razón fue necesario sintetizar nuevos antibacterianos de esta
familia para mejorar el espectro de actividad, el perfil farmacocinético,
disminuir los efectos adversos y la aparición de resistencia bacteriana. Este
nuevo grupo son las llamadas fluoroquinolonas, generadas durante la década de
los 80.
|
|
Muchos investigadores
coinciden en que la reacción de
Gould-Jacobs[1],
es la base principal de la síntesis de las primeras quinolonas de uso
farmacológico, ocurrida en la década de los años sesenta, esta reacción,
presenta la siguiente secuencia:
En los años
siguientes, se han introducido en el anillo básico de las benzoquinolonas, el
flúor en la posición 6 y diversos grupos de heterociclos en la posición 7, para
dar lugar a las fluoroquinolonas de mayor espectro antibacteriano.
Partes importantes de
las metodologías utilizadas en estas síntesis han sido recopiladas por Leyva S
y Leyva E[2] en un
trabajo muy bueno desde la perspectiva bioquímica.
El método de las
desconexiones aplicado al reporte de las síntesis que se estudian y las
reacciones de las primeras etapas de las síntesis son de entera responsabilidad
del autor de esta monografía[3].
i) Síntesis reportada por Koga H. et al.[4]
Análisis
retrosintético:
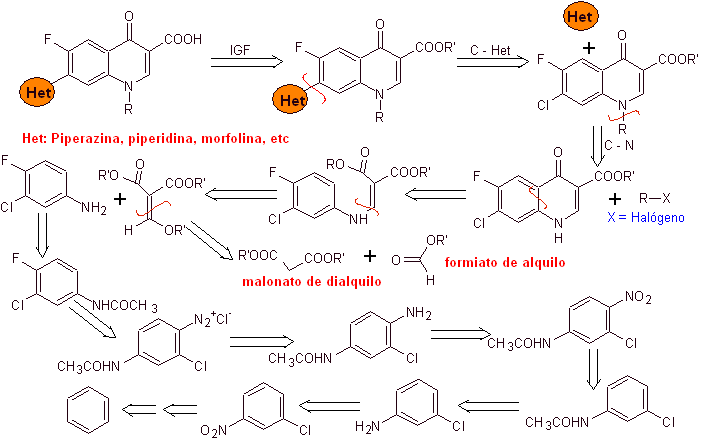
Síntesis:
Se parte del
benceno para formar la 3-cloro-4-fluoroanilina, que reacciona con el EMME de
dietilo para producir el acrilato correspondiente, que por calentamiento, forma
un compuesto cíclico. Este compuesto a su vez se hace reaccionar con un agente
alquilante y posteriormente se introduce el compuesto heterocíclico
nitrogenado, para finalmente hidrolizar y obtener la molécula objetivo.
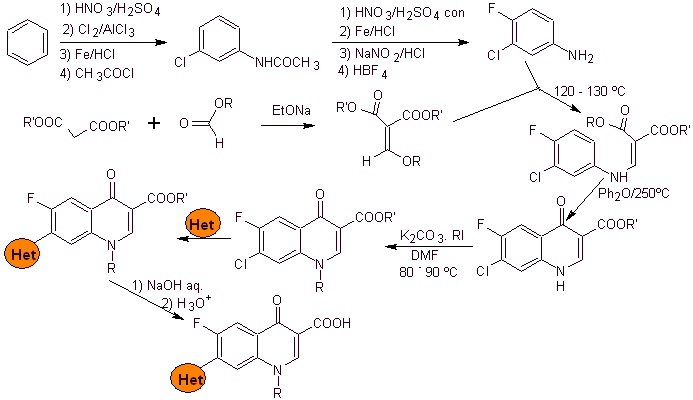
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 34037
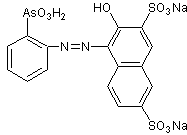
SÍNTESIS DE LA THORINA
|
Resumen: La síntesis de la Thorina, un reactivo cromógeno de amplio uso para el análisis espectrofotométrico de varios elementos, se encara dentro el paradigma de la retrosíntesis, lo que origina más de once rutas de síntesis diferentes, de las cuales se informa de dos de ellas. Los rendimientos y la identificación inequívoca de la thorina por IR y RMN, demuestran que los diseños de síntesis efectuados son los más adecuados y los espectros señalan del grado de pureza óptimo alcanzado en los procesos de recristalización de la Thorina sintetizada. |
|
|
|
|
|
|
|
El ácido 2-(3,6-disulfonato sódico-2-hidroxi-1-naftilazo) bencenarsónico, más conocido como thorín 1, thorina o simplemente torina, es ampliamente utilizado como reactivo cromógeno para el análisis espectrofotométrico de varios elemento, entre ellos el litio a 486 nm[1]. |
Thorina |
|
Las aplicaciones analíticas de la thorina, los parámetros de trabajo, sus limitaciones y perspectivas, son abordadas y explicadas con suficiente detalle, en las publicaciones especializadas de análisis químico como es el Analitical Chemistry. Un breve resumen, de los mismos, muestra las siguientes aplicaciones:
En medio ácido: se utiliza para la determinación cuantitativa de los elementos thorio (Th), zirconio (Zr), flúor (F), hafnio (Hf) y uranio (U).
En medio básico: Es utilizada la forma ácida disulfónica de la thorina, más conocida como Thorón, en la determinación cuantitativa del litio (Li).
En medio neutro: la thorina es utilizada como indicador para la determinación de iones sulfato (SO42- ) en soluciones acuosas.
La thorina también es utilizada para determinar el SO2 en el aire.
Problema de investigación.
Dada la demanda de este reactivo para diferentes determinaciones analíticas y particularmente para el análisis colorimétrico del litio en salmueras proveniente del Gran Salar de Uyuni y la poca oferta del mismo en el mercado nacional, surge la necesidad de sintetizar la thorina, a partir de materiales simples y asequibles en nuestro medio.
Con esta finalidad, las rutas de síntesis diseñadas, se lo encara desde el paradigma de la RETROSÍNTESIS, siendo aplicables los métodos de Las Hojas de Síntesis, Método de las desconexiones o del Sintón y el Método del Árbol de Síntesis.
En relación a la síntesis de la thorina, existe en la literatura una descripción breve y resumida de la síntesis del thorón[2], de acuerdo a la dirección propuesta por Kuznetsov, es decir, se indica que para la preparación del thorón, se requiere que el ácido o-aminofenilarsónico, diazocopule con la sal disódica del ácido 2-naptol-3,6-disulfónico (sal R) en medio ácido.
Diseño de síntesis para la Thorina.
El diseño se lo encara por el método de las desconexiones o del Sintón, que contempla dos etapas. La primera está relacionada con el análisis retrosintético y la segunda con la síntesis en dirección de lo que ocurre en el laboratorio, es decir a partir de los materiales de partida hasta arribar a la Molécula Objetivo (MOb).
a) Elementos estructurales y de reactividad a ser considerados, para el análisis retrosintético
La thorina es un compuesto típicamente azoico, por lo tanto un colorante. La preparación de estos compuestos comprenden generalmente dos reacciones fundamentales, que son: la diazoación y la diazocopulación (o simplemente copulación).
Por otro lado, todas las moléculas precursoras de copulación utilizadas para la formación de colorantes azoicos, poseen un carácter común, esto es: un átomo activo de hidrógeno ligado a un átomo de carbono.
Son de uso amplio como moléculas precursoras (sustratos) para la copulación, las siguientes: Compuestos que poseen hidroxilos fenólicos, como los fenoles y naftoles, Aminas aromáticas, Moléculas con grupo cetónico enolizables de carácter alifático y Moléculas heterocíclicas como el pirrol, indol, etc.
En relación a la reacción de copulación, se debe tener en cuenta ciertos principios heurísticos, a saber:
· Los fenoles se copulan más fácilmente que las aminas y los miembros de la serie del naftaleno más fácilmente que las del benceno.
· Los sustituyentes con efecto inductivo negativo (-I), como los halógenos, grupos nitro, sulfa, carboxilo y carbonilo retardan la copulación.
· Un grupo alquilo o alcoxi en posición orto o meta con respecto a un grupo amino estimula la copulación. Y si se hallan en las posiciones 2 y 5 con respecto al grupo amino, son copuladores especialmente buenos.
· En la serie del benceno, la copulación ocurre ordinariamente en la posición para con respecto al grupo hidroxilo (-OH) o amino (-NH2). Si la posición para esta ocupada, el enlace ocurre en la posición orto.
· En la serie del naftaleno, cuando el grupo hidroxilo amino está en la posición 2 (b), el reactivo se copula en la posición 1 (a). Si el grupo hidroxilo o amino está en la posición alfa, el enlace suele producirse en la posición 4; pero si la posición 3 o 6 están ocupados por un grupo sulfónico, la unión se efectúa en la posición beta.
· Cuando existen dos posiciones posibles de copulación, la posición del enlace es decidida frecuentemente por el pH del medio: La copulación se produce en orto con el grupo amino cuando se realiza en medio ácido y en orto con el grupo hidroxilo cuando se realiza en medio básico.