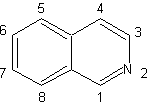
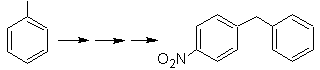SÍNTESIS ORGÁNICA
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 27637
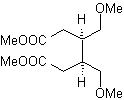
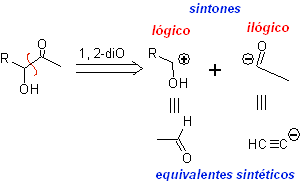
Desconexión de compuestos 1,2-dioxigenados
1.- Compuestos a-hidroxicarbonílicos
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 27330
SÍNTESIS DE HETEROCICLOS POR CICLACIÓN INTRAMOLECULAR
La construcción de sistemas heterocíclicos también utiliza estas mismas
reacciones, con la particularidad de que en el sistema heterocíclico debe estar
presente o contener al menos un átomo diferente al carbono. Los más comunes son
el nitrógeno, oxigeno, azufre y fósforo.
El sistema cíclico de la molécula que se desea sintetizar, puede
provenir de la modificación de un sistema cíclico presente en alguno de los
reactivos implicados en la síntesis o ser el resultado de la ciclación de
antecedentes no cíclicos y que ha sido construido en el desarrollo de la
síntesis por ciclación intramolecular o por métodos basados en ciclaciones
intermoleculares (cicloadiciones).
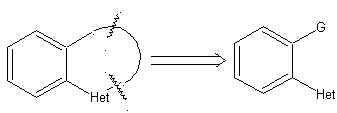
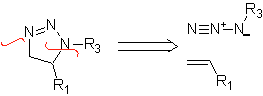
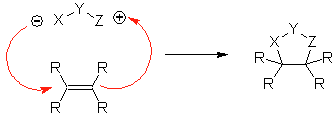
1. Ciclación intramolecular
Las reglas generales de desconexión de heterociclos provenientes de una
ciclación intramolecular, fueron adecuadamente sistematizadas por J. I. Borrell[1],
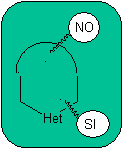
las mismas que se asumen en la presente sección (Het = N, O, S)
1.
En la síntesis de un compuesto monociclico, el cierre del
anillo supone generalmente la formación de un enlace carbono- heteroátomo.
|
Modelo:
|
|
|
Ejemplo: |
|
|
|
|
|
|
Ejemplo:
|
|
|
Modelo:
|
|
|
Ejemplo:
|
|
[1] BORRELL J.I. “Introducción
al Análisis Retrosintético”. Cap. 8.Laboratori de Sintesi. Grup
d’Enginyería Molecular (GEM). Institut Químic de Sarriá, Universitat Ramon
Llull. España. (Diapositivas de apoyo para Clases)
Leer más: Síntesis de heterociclos por ciclación intramolecular
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 28674
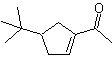
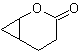
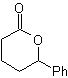
DESCONEXIÓN DE COMPUESTOS 1,4-DIOXIGENADOS
Otro grupo de compuestos de mucha importancia en la síntesis química, lo constituyen las moléculas dioxigenadas que se hallan en una relación de distancia 1,4. Estos compuestos cuando se someten a un análisis de desconexión retrosintético, generan sintones, en donde uno de ellos, el electrófilo o nucleófilo, puede ser considerado “anómalo” o “ilógico”, en razón a que la carga asignada a uno de los átomos no puede explicarse en términos de la electronegatividad intrínseca o inducida del mismo.
1. Compuestos 1,4-dioxigenados (1,4-diO)
En este tipo de compuestos, la desconexión conduce también a un sintón lógico y a otro sintón ilógico (no natural), que puede ser un nucleófilo o un electrófilo, cuyo equivalente sintético, tiene que ser todavía reelaborado adecuadamente, para poder ser utilizado en la reacción química.
1. 1. Compuestos 1,4-dicarbonílicos
1.1.1. Compuestos 1,4- dicetónicos
Las alternativas de desconexión de este tipo de compuestos o moléculas a ser sintetizadas (MOb), pueden conducir a las siguientes opciones:
a. Un sintón aniónico lógico y un sintón catiónico ilógico
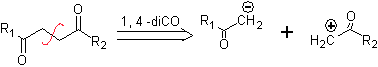
El equivalente sintético del anión es el ión enolato o el mismo enol del compuesto carbonílico. En cambio el equivalente sintético para el carbocatión es el alfa halocarbonilo. (Umpoloung)
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 23288
MOb: 75  |
MOb: 76 |
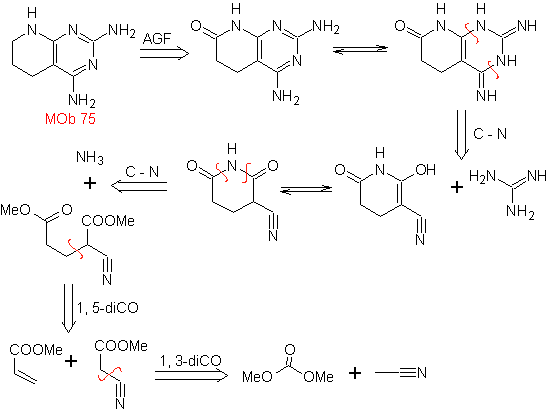
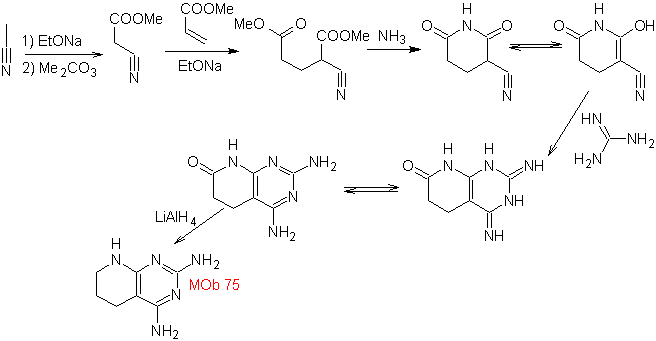
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 22890
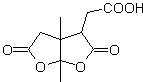
DESCONEXIÓN DE COMPUESTOS 1,6-DIOXIGENADOS
Los compuestos 1,6 difuncionalizados, preferentemente utilizan la estrategia de la reconexión para su respectiva síntesis; esta estrategia, puede muy bien combinarse con la reacción de Diels-Alder, que en general forma como producto, aductos olefínicos de seis eslabones o la reducción de Birch de anillos bencénicos, que igualmente genera productos olefínicos de seis eslabones
1. Compuestos 1,6 dioxigenados
La reacción que genera compuestos dicarbonílicos, de diferente combinación posible: dicetonas, cetoácidos, cetoaldehidos, diácidos, etc y a diferentes distancia la una de la otra, sin duda, es la reacción de ozonólisis de compuestos olefínicos.
Dependiendo de la estructura del sustrato y las condiciones de la reacción sobre el ozónido intermedio formado, se conseguirán una diversidad enorme de compuestos como resultado de la ruptura del doble enlace olefínico. De ellos, son de especial interés aquellos que se hallan en una relación 1, 6 – dioxigenada, como puede colegirse de la siguiente operación sintética de “reconexión”:
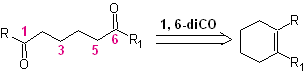
La mejor manera de comprender el funcionamiento de esta “operación sintética de reconexión”, se lo conseguirá a través de la solución de la síntesis de las siguientes moléculas orgánicas:
|
MOb 50
|
|
MOb 51
|
|
MOb 52
|
|
|
|
|
|
|
|
MOb 53
|
|
MOb 54
|
|
MOb 55
|
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 28578
Síntesis de heterociclos con varios heteroátomos
Los compuestos heterocíclicos como ya se tiene dicho
poseen una amplia gama de aplicaciones: predominan entre los compuestos usados
como farmacéuticos, agroquímicos y de uso veterinario; se utilizan como aditivos
abrillantadores, antioxidantes, inhibidores de la corrosión, como colorantes y
pigmentos; y en muchas aplicaciones más.
Por lo tanto es razonable, que actualmente gran parte
de las investigaciones en química traten de la síntesis y propiedades de los
compuestos heterocíclicos. A ese fin se orienta este artículo que pretende
proporcionar a los estudiantes de química herramientas básicas de la
retrosíntesis.
El proceso de desconexión para moléculas con varios
heteroátomos, puede realizarse para cada enlace carbono-heteroátomos, de
acuerdo a los modelos anteriormente estudiados o simultáneamente, para lo cual
se utilizan reactivos poliheteroatómicos asequibles.
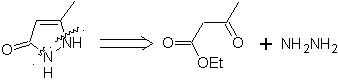
1. Heteroátomos a distancia (1, 2)
Los reactivos más representativos y usuales son, las hidrazinas
e hidrazinas sustituidas, así como la hidroxilaminas.
|
Hidracina |
Hidroxilamina |
Proponer un diseño de síntesis, a partir de materiales simples, para las
siguientes moléculas:
|
|
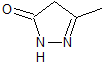
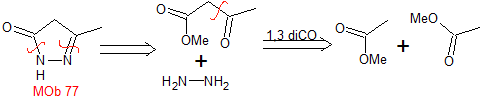
MOb 77
pirazoles |
|
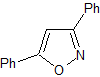
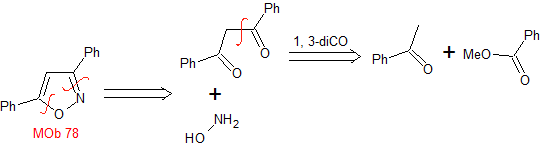
MOb 78
isoxazoles |
|
MOb 79
piridacinas |
MOb 77. Análisis retrosintético. La MOb es un
derivado del pirazol y se desconecta directamente por los enlaces C-N, para
generar precursores simples como la hidracina y un compuesto 1,3-diCO.
|
|
|
Síntesis. El acetato de metilo, es un buen precursor para
formar el compuesto 1,3-diCO, el cual se combina con la hidrazina para
generar la MOb 77. |
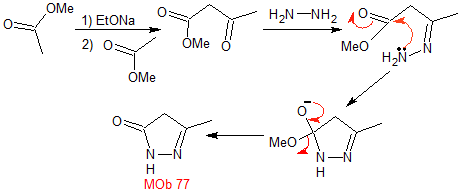
MOb 78- Análisis retrosintético.
|
|
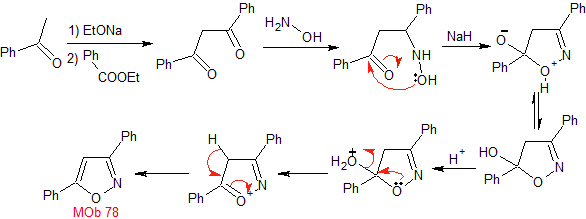
Síntesis. La bezofenona y
el benzoato de etilo permiten formar el 1,3-diCO requerido, para reaccionar en
medio ligeramente ácido con la hidroxilamina y luego de agregar el NaH, se da
la ciclación, que requiere de mayor ácido para
deshidratar y producir finalmente
|
|
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 26569
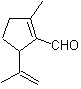
Oxidación de Baeyer–Villiger
Otra reacción que puede asociarse a la estrategia de la retrosíntesis, es la oxidación de cetonas por
peroxiácidos, mas conocida como reacción de Baeyer-Villiger. En cetonas
cíclicas, la oxidación con perácidos, genera lactonas. Los grupos unidos a las
cetonas asimétricas, poseen una aptitud migratoria, que permite, en términos
literales, “ insertar un átomo de oxigeno” entre el grupo carbonilo y el grupo
migrante, produciéndose así, un éster o una lactona.
Se debe tomar en cuenta, que las enonas (cetonas α, β
insaturadas) no son buenos sustratos para la oxidación de Baeyer-Villiger, en
razón a que el alqueno es mucho mas reactivo que la cetona. Sin embargo hay estructuras especiales donde el alqueno
puede ser protegido por un sustituyente cercano por el efecto estérico y
orientarse de este modo el ataque del peracido hacia el grupo carbonilo.
|
|
… |
|
Recuérdese que la aptitud migratoria de los diferentes
grupos, en la reacción de Baeyer-Villiger, es como sigue:
H > Ph
> alquilo 3º > cicloalquilo
> alquilo 2º > alquilo 1º > Me
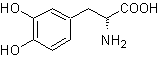
Proponer un plan de síntesis para las siguientes moléculas:
|
MOb 56
L-Dopa |
. |
MOb 57
|
. |
MOb 58
|
|
|
|
|
|
|
|
MOb 59
|
|
MOb 60
|
|
MOb 61
|
MOb 56. Análisis retrosintético.
El alfa aminoácido, de
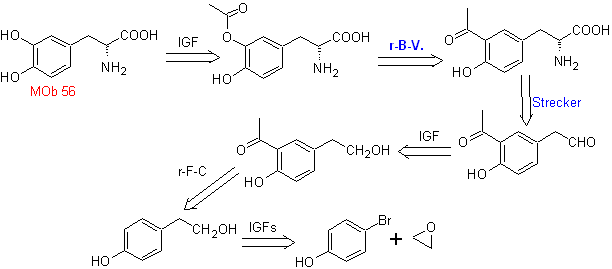
Síntesis.
Para la formación del Grignard
requerido, se protege el OH orto del benceno. La síntesis de Strecker, permite
formar el alfa aminoácido, que es oxidado de acuerdo a Baeyer-Villiger con un
perácido y el producto se somete a una hidrólisis ácida del grupo éster, lo que
conduce a la formación de
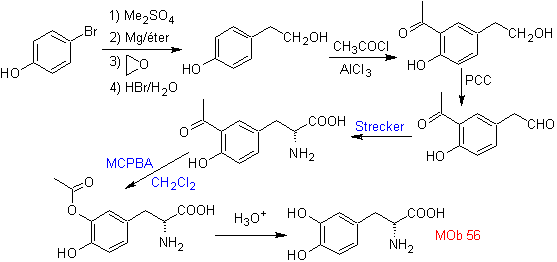
Leer más: La oxidación de Baeyer-Villiger como estrategia en la Retrosíntesis
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 25947
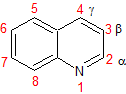
Síntesis de Quinoleínas
(Método de las
desconexiones)
|
|
Las quinoleínas
compuestos formados por núcleos derivados del benceno y piridina se
encuentran en numerosos alcaloides, en cierto tipo de colorantes y en un
considerable número de fármacos, por lo que son de gran interés comercial en
los laboratorios industriales. |
Aquí se mencionarán sólo aquellos métodos de
síntesis, que producen rendimientos aceptables en sus reacciones:
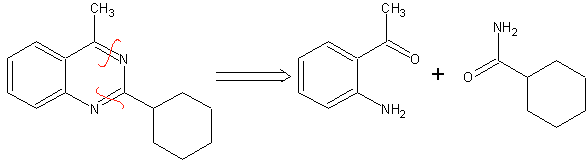
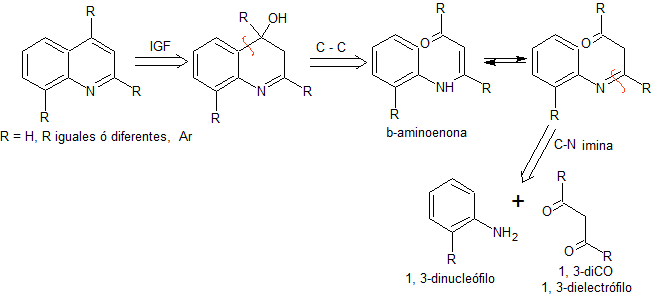
1.
Síntesis de
COMBES
En este método, inicialmente se realiza la condensación
de un compuesto 1,3-diCO con una anilina o su derivado, para formar una
β-aminoenona, que posteriormente se cicla en medio ácido concentrado al
correspondiente derivado quinolénico. En
términos retrosintéticos, la síntesis de COMBES, se expresaría del siguiente
modo:
|
|
|
Proponer un plan de síntesis para
|
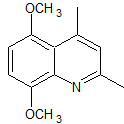
MOb 95:
|
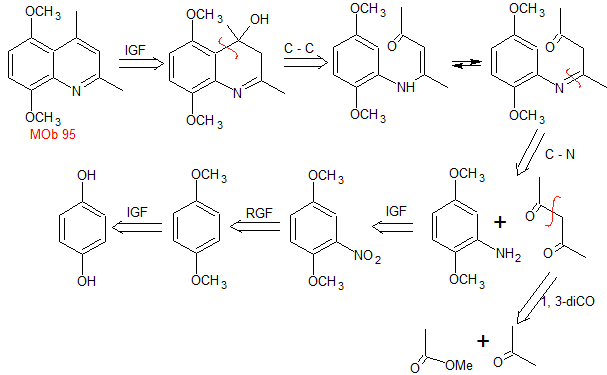
MOb. 95. Análisis retrosintético: Inicialmente se
funcionaliza la MOb, para proceder a desconectarlo, según Combes y generar de
este modo equivalentes sintéticos que conduzcan a moléculas precursoras
1,3-dinucleófilo y 1,3-dielectrófilo.
|
|
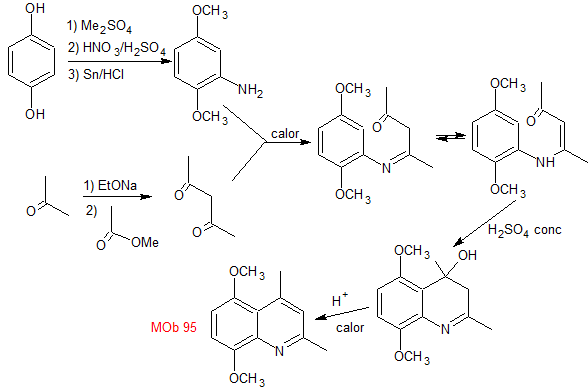
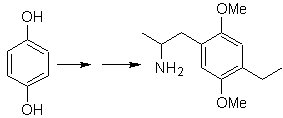
Síntesis: La hidroquinona
permite formar la 2,5-dimetoxianilina como 1.3 dinucleófilo. La condensación de la acetona y acetato de metilo, conducen a la
2,4-pentanodiona, que funciona muy bien como un 1,3-dielectrófilo. Combinadas
ambas moléculas precursoras, utilizando ácido sulfúrico concentrado para
promover la ciclación y por un calentamiento posterior se llega a formar
|
|
|
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 31218
La transposición de
Beckmann como estrategia en
La transposición de oximas en medio acido, denominada
transposición de Beckman, produce una amida o lactama si la cetona de partida
es lineal o cíclica respectivamente.
Para mejorar el rendimiento de este tipo de reacciones se han
estudiado varios catalizadores y medios ácidos. Así por ejemplo, nuevos medios
ácidos utilizados como catalizadores, con el propósito indicado, lo
constituyen, el TCT/DMF, DAST/CH2CL2 , CF3SO3H,
PCl5, HgCl2/MeCN y
el ZnO.
|
TCT:
Triclorotriazina |
…… |
DAST:
Trifluoruro de
dietilaminosulfuro |
La aptitud migratoria de los grupos es la misma que en la
reacción de Baeyer – Villiger. Proponer un diseño de síntesis para cada una de
las siguientes moléculas:
|
|
MOb 62
|
|
MOb 63
|
|
MOb 64
|
MOb 62. Análisis
retrosintético.
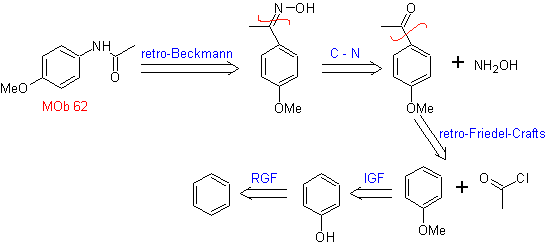
Síntesis. La reacción de la cetona aromática intermedia con NH2OH y su posterior tratamiento con una solución acuosa de ácido sulfúrico y ZnO, permite formar la amida aromática MOb 62.
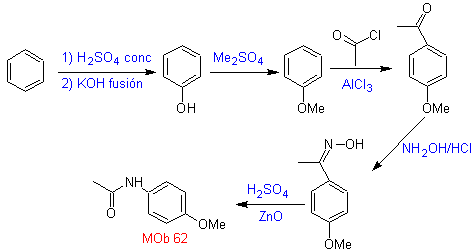
Leer más: La transposición de Beckmann como estrategia en la Retrosíntesis
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 21599
Síntesis
de Isoquinoleinas
(Por
el método de las desconexiones)
|
|
Las
isoquinoleinas difieren estructuralmente de las quinoleinas en la
posición del nitrógeno, ya que esta
última, no se encuentra fusionada, por lo que presenta una “reactividad
alifática”.
No se encuentra libre en la
naturaleza, pero el ciclo de la isoquinoleina se encuentra en algunos
alcaloides, en forma aromática o reducida, por ejemplo, la papaverina. |
Los métodos sintéticos más conocidos para la preparación de isoquinoleinas
se inician con 2-feniletilaminas y comprenden una ciclación por intermedio de
un carbono adicional proporcionado por el grupo carbonilo de otro compuesto.
Los principales métodos sintéticos son: La síntesis de Pomeranz-Fritsch, la
síntesis de Bischler-Napieralski, síntesis de Pictet-Gams y la síntesis de
Pictet-Spengler.
1. Síntesis
de POMERANZ-FRITSCH.
Este método de
síntesis de la isoquinoleina, se produce en dos etapas:
a.
En primer lugar, se condensa el benzaldehído
(1,3-electrófilo-nucleófilo) con el dietilacetal del aminoacetaldehido
(1,3-nucleófilo-electrófilo) para formar una aldimina estable.
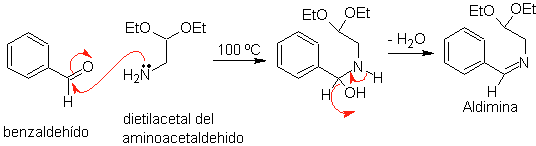
b.
Seguidamente, la aldimina cicla en un medio ácido fuerte,
a una imina, con eliminación simultánea de etanol, para producir una
isoquinoleina.
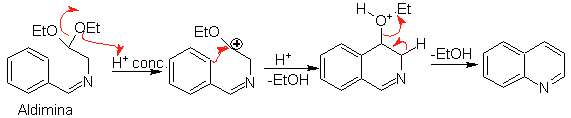
Esta segunda etapa, al ser una sustitución electrofílica, está sujeta al
efecto que tienen en dicha reacción los sustituyentes aceptores o donadores de
electrones sobre el anillo bencénico. Sin embargo, debido a la hidrólisis de la
imina formada, en el medio ácido fuerte utilizado en la reacción, reduce el
rendimiento del proceso.
Este método, permite acceder a isoquinoleinas sustituidas en el C-1, para
lo cual se han probado cetonas aromáticas, con rendimientos muy bajos. No
obstante, se ha tenido mayor éxito al utilizar la variante de las bencilaminas
adecuadamente sustituidas como 1,4-dinucleófilos y el dietilacetal del glioxal
como 1,2-dielectrólfilos
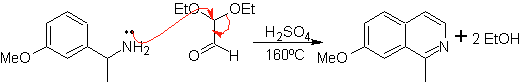
Algo que debe quedar en claro, es que el método de Pomeranz-Fritsch y su
variante, anteriormente analizada, no permiten preparar isoquinoleinas
sustituidas en el C-3 y el C-4 del heteroátomo. El análisis retrosintético de
este método, muestra los posibles intermediarios implicados en la reacción y
los materiales probables de partida.
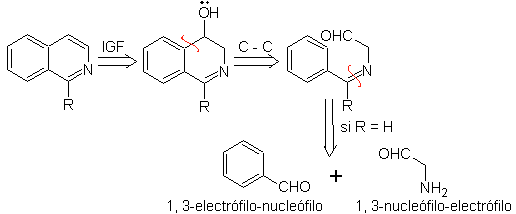
|
Proponer un
diseño de síntesis, para cada una de las siguientes isoquinoleinas:
|
MOb
107
|
|
MOb 108
|
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 21915
Otras estrategias de síntesis
que utilizan sintones “ilógicos”
1.
Adición de triple enlace
La estrategia de "adicionar" un triple enlace, entre
dos funciones oxigenadas en posición 1,4, permite trabajar posteriormente con una desconexión
basada en la química de los acetiluros. Con el fín de ejemplificar esta estrategia, veamos la e laboración de un plan de
síntesis para
MOb.
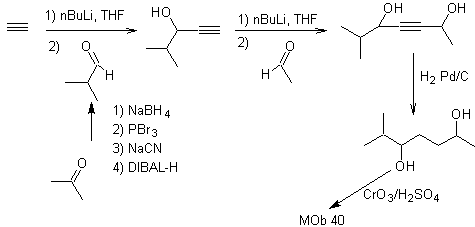
40. Análisis
retrosintético. Una primera IGF en
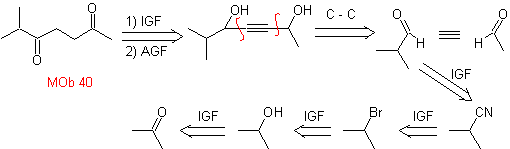
Síntesis. El diacetiluro o
acetiluro por etapas, se combina con moléculas de aldehídos diferentes, se hidrogenan la
molécula intermedia formada y seguidamente se oxida los alcoholes de la misma
al compuesto dicetónico Mob 40.
Las γ-lactonas, pueden también prepararse de manera análoga,
como se muestra a continuación:

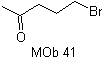
2.
Adición del grupo COOR como grupo
activante
La adición del grupo COOR, además de activar el sintón
aniónico, facilita la desconexión de una molécula 1,4 diX.
|
Sintetizar |
|
MOb 41. Análisis retrosintético.
Leer más: Otras estrategias de síntesis que utilizan sintones "ilógicos·
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 17535
Síntesis
de BENZODIAZINAS
(Por
el método de las desconexiones)
Las
estructuras de las benzodiazinas, se encuentran en muchos alcaloides, principalmente como un
sistema de anillo quinazolónico. Los otros derivados de la benzodiazina, como
las cinnolinas, quinoxalinas y ftalizinas, son también parte importante de
muchos fármacos de un espectro de uso significativo, que los hacen en general,
muy importantes dentro la síntesis orgánica y particularmente la
farmacoquímica. Así, se los puede encontrar como antiinflamatorios,
antihipertensivos, antibacterianos, analgésicos, antibióticos, etc.
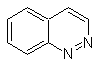
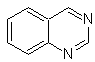
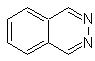
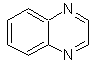
|
Cinnolina |
|
Quinazolina |
|
Ftalizina |
|
Quinoxalina |
Síntesis de las Cinnolinas
De acuerdo a
la estructura que presenta la cinnolina, se tiene las siguientes opciones para
su síntesis:
![]() Síntesis de von Richter:
Síntesis de von Richter:
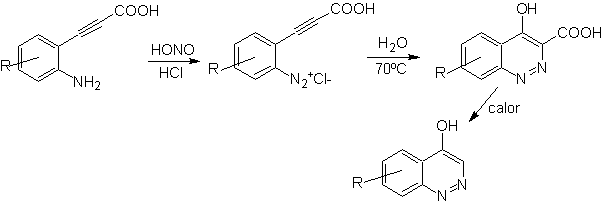
![]() Síntesis de Widman – Stoermer:
Síntesis de Widman – Stoermer:
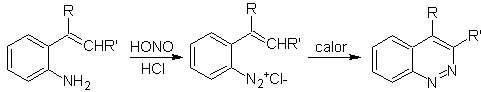
|
Proponer
un plan de síntesis para la siguiente molécula:
|
MOb 114
|
MOb 114. Análisis retrosintético.
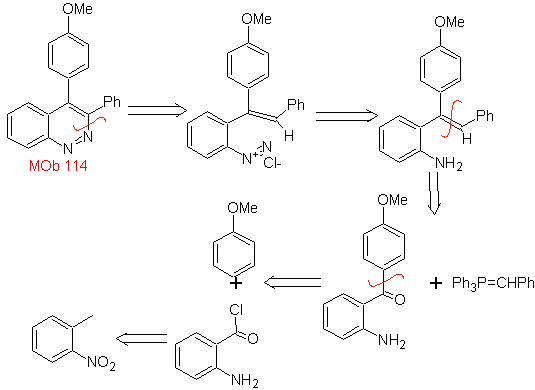
Síntesis La formación
de
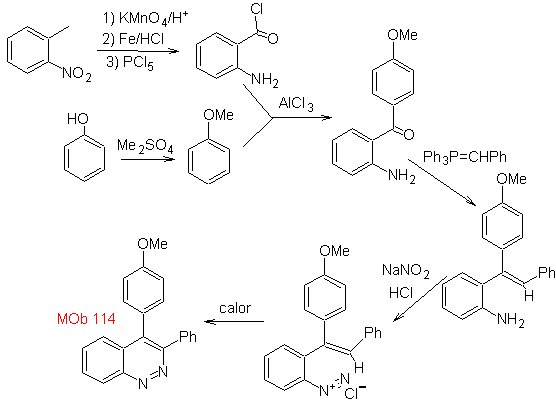
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 56658
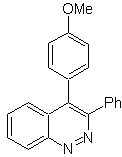
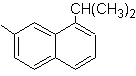
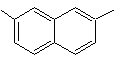
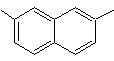
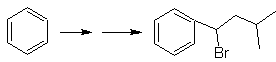
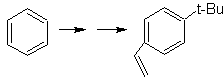
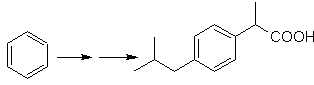
SÍNTESIS DE COMPUESTOS AROMÁTICOS I
(Método del Árbol de Síntesis)
Proponer un plan de síntesis, a
partir del tolueno o xileno como materiales de partida, para las siguientes
moléculas:
|
(MOb 12)
1-isopropil-7-metilnaftaleno |
(MOb 13)
2,7-dimetilnaftaleno |
|
|
|
|
(MOb 14)
1-isopropil-6-metilnaftalen
|
(MOb 15)
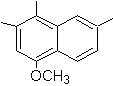
4-metox-1,2,7-trimetilnaftaleno |
Solución:
(MOb 12).
En la estrategia que se asume, se
toma en cuenta que la última etapa puede responder a un proceso de
“aromatizacion”, por lo cual se propone que la molécula precursora presenta un
anillo no aromático, con un doble enlace
sobre el carbono que contiene el doble enlace y el grupo alquilico.
Esta
estructura se puede conseguir por la acción del un Grignard sobre un carbonilo
y la posterior deshidratación del alcohol formado. La cetona se forma por la
acilación sobre el compuesto bencénico adecuado con el anhídrido succínico y
sus posteriores cierres intramoleculares de acilación de Friedel -Crafts.
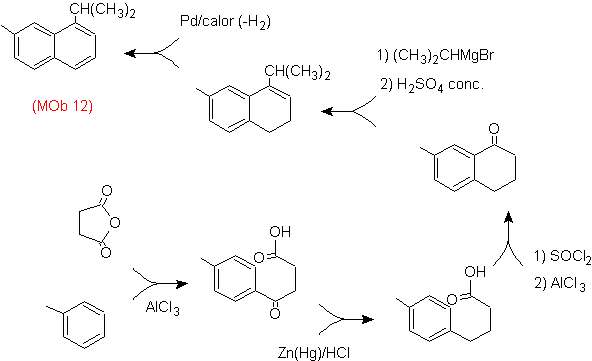
Solución (MOb
13).
Nuevamente la molécula precursora
tiene que se “aromatizada”, la estrategia mas adecuada de entre otras se basa en la combinación de acilación con
anhídrido succínico sustituido y la reducción de Clemmensen.
El
carbonilo final se reduce a alcohol que será deshidratado luego con hidrogeno
molecular y un catalizador denominado cromilo de cobre.
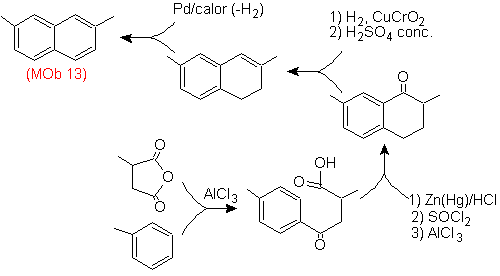
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 74866
Síntesis
de INDOLES
(Por
el método de las desconexiones)
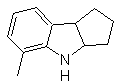
El sistema de anillos del indol se ha encontrado en muchos compuestos
naturales de gran interés químico y bioquímico, razón por la cual se afirma que es el más abundante en la naturaleza. Así, el triptófano es un
aminoácido esencial, el índigo un colorante y el ácido indolil-3-acético, una
hormona de crecimiento vegetal. Por otro lado, el interés en estas moléculas
surge de su uso farmacológico, son un ejemplo el sumatriptan (antimigrañas) y
el frovatriptan también antimigrañas.
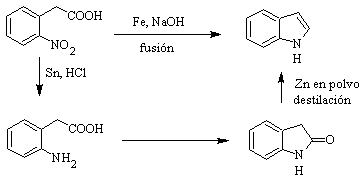
El indol es un sólido cristalino incoloro de p.f. 52ºC, fácilmente soluble en la mayoría de los disolventes orgánicos y cristaliza en agua, tiene olor agradable y por esa razón también se lo usa como base de perfumes.
Fué preparado por primera vez en 1866 por calentamiento del oxindol con polvo de cinc y ha venido a ser un producto comercial importante. Baeyer en 1869 propuso la siguiente síntesis:
Los métodos de síntesis clásicos de indoles, son los de Fischer, Bischler,
Reissert y Leimgruber-Batcho, Bartoli, Larock, Gassman, Sugasawa, Fukuyama, Hegedus y Dobbs.
1.
Síntesis
de FISCHER
Consiste en calentar fenilhidrazonas de cetonas o aldehídos, con cloruro de
zinc anhidro, trifluoruro de boro, ácido polifosfórico, o algún otro
catalizador acido, para producir indoles. Ocurre una transposición, catalizada
por ácidos, de una fenilhidrazona con eliminación de agua y NH3. Los
grupos electrodonadores favorecen la ciclación y los electroatractores la
dificultan.
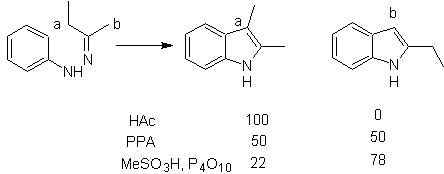
Con cetonas asimétricas, la ciclación intramolecular de la hidrazona puede
conducir a dos indoles isómeros en distintas proporciones según las condiciones
utilizadas, en medios fuertemente ácidos, puede predominar el indol menos
sustituido.
Cuando existen sustituyentes en meta, respecto al nitrógeno de la
hidrazona, la ciclación puede tener lugar en dos posiciones, que conducen a dos
indoles isómeros:
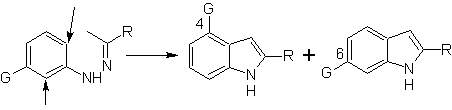
Si el sustituyente G es electroatractor, los dos isómeros (4- y 6-) se
forman aproximadamente en la misma proporción. En cambio si G es un
sustituyente electrodonador, se forma mayoritariamente el isómero sustituido en
6. El análisis retrosintético del indol formado por la síntesis de Fischer, se
puede plantear de la siguiente manera:
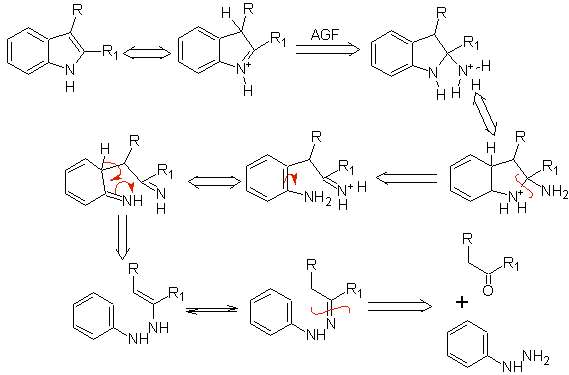
|
Proponer
un plan de síntesis para las siguientes moléculas:
|
MOb 119
|
|
MOb 120
|
MOb
119. Análisis
retrosintético. La desconexión fundamental en los indoles que se supone,
se forman por la síntesis de Fischer, corresponde a una retro-transposición,
que se muestra en la desconexión de
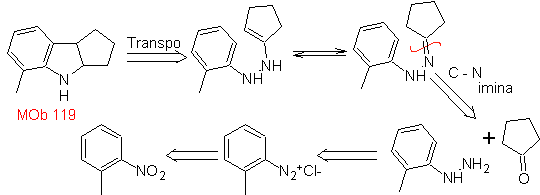
Síntesis:
A partir del orto-nitrotolueno, se genera el derivado intermedio de la
fenilhidrazina, necesaria en la síntesis de indoles de Fischer, se forma la
imina con una ciclopentanona, y por calentamiento de forma
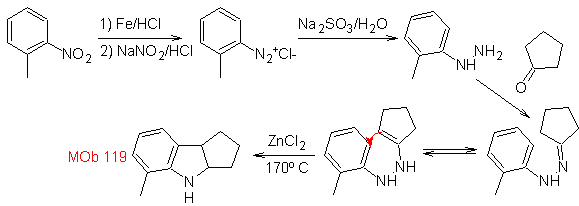
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 31170
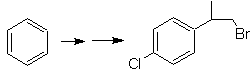
SINTESIS DE COMPUESTOS AROMÁTICOS
II
(Método del Árbol de
Síntesis)
Si bien uno de los primeros
problemas a resolver en la síntesis de los compuestos aromáticos multi-
sustituidos, es el control de los efectos orientadores y la formación de
isómeros no deseados, es también importante estudiar la reactividad de los
arenos, en tanto que en algún sentido la presencia de grupos alifáticos en el
compuesto aromático, muchas veces, presentan características y reactividades,
propias del tipo de compuesto orgánico al que pertenecen y las particulares
que resultan de la interacción mutua de los grupos alifáticos y aromáticos.
En ese propósito, se basa,
la síntesis de las moléculas Nº 20 al
27, esta vez a partir de materiales
especificados, por lo que la interrogante, se presenta del siguiente modo: ¿Cuáles
son las reacciones que justifican las
siguientes transformaciones?:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
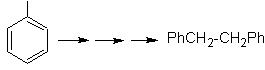
Solución MOb
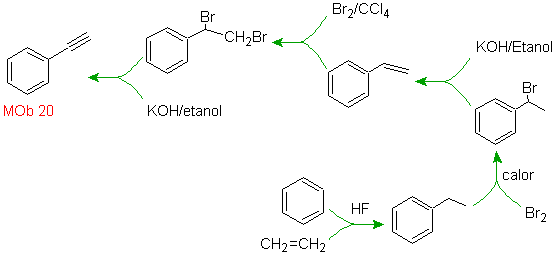
20.
Sabemos que no existe la
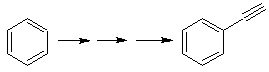
posibilidad de que el ión acetiluro actúe directamente sobre el benceno, por
consiguiente el triple enlace se obtiene
a partir de un grupo alquílico
vec-dibromado, que se obtiene por bromación del estireno, obtenido
previamente por una deshidrobromacion de
un haluro de bencilo formado por una bromación por el mecanismo de radicales
libres sobre el etilbenceno
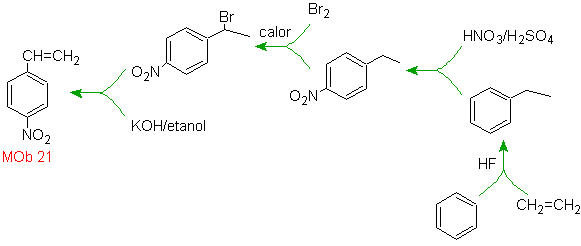
Solución MOb
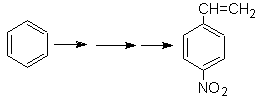
21.
El para nitroestireno, no es
posible obtener por nitración directa del estireno, debido a que el grupo
etenilo unido al anillo es inestable en las condiciones de la nitración.
En tal virtud la molécula
precursora tendrá un grupo que sea fácil de deshidrobromar. Este precursor se
obtiene por Bromación de radicales del grupo etilo ligado al anillo bencénico,
que previamente fue nitrado mayoritariamente en la posición para.
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 23731
Síntesis de
Benzofuranos y Benzotiofenos
(Por
el método de las desconexiones)
1. Síntesis
de Benzofuranos
El benzofurano, usualmente llamado cumarona, es un liquido incoloro, que es aislado del
alquitrán de hulla y es mucho más estable al ataque químico que el furano.
Se hará mención y desarrollaran las síntesis más clásicas para la
preparación de benzofuranos:
a. A partir de la cumarina
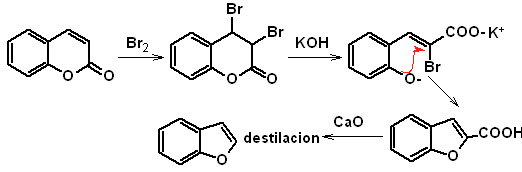
b. A partir de una reacción de condensación de Claisen interna
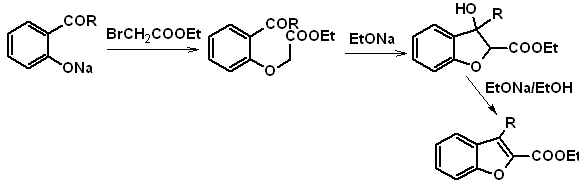
c.
A partir de una
transposición de Claisen
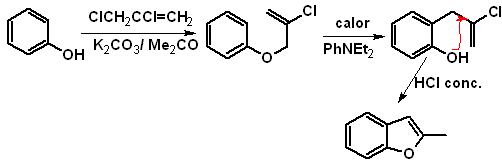
Proponer un diseño de
síntesis, para los siguientes benzofuranos:
|
: |
MOb
127
|
… |
MOb
128
|
MOb
127, Análisis
retrosintético. La estrategia de desconexión, en
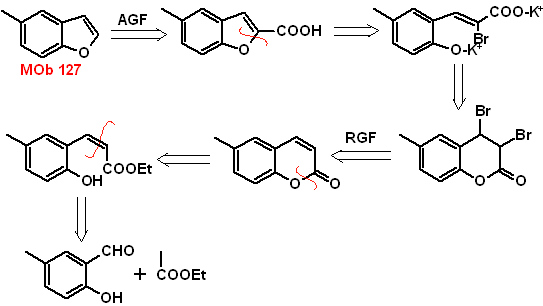
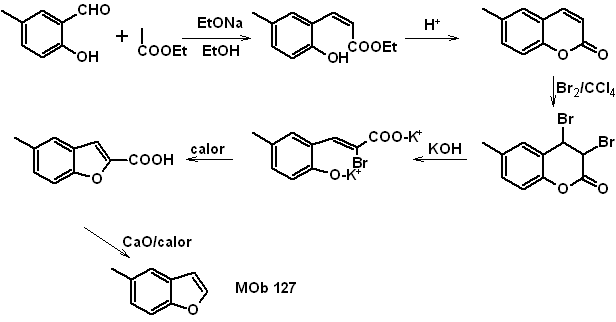
Síntesis.
El intermediario 2-hidroxi-5-metilbenzaldehido, se prepara a partir del
benceno. El derivado de la cumarina que se forma, se halogena hidroliza en sol
de KOH y posteriormente se calienta con CaO, para descarboxilar y así formar
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 34008
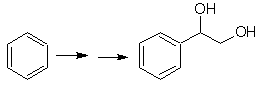
SÍNTESIS
DE ALCOHOLES
(Método del
Árbol de Síntesis)
Proponer un plan de síntesis, para
las moléculas objetivo señaladas a partir de moléculas simples que se indican
(MOb 30 -41). Para ello, utilice los reactivos y condiciones de reacción que
crea necesarios:
Solución
MOb 30.
Estrategia:
Se observa que la molécula de partida ha sido deshidratada y en la posición
alílica inicialmente no sustituida, se ha desplazado un hidrógeno por el grupo
ciano o nitrilo. Esta última reacción puede ocurrir sólo si la molécula
precursora es un haluro alílico, razón por la cual se propone a la misma como
precursora de
El Br se introduce en la posición
deseada con el NBS y el alqueno es producto de la deshidratación de la molécula
de partida.
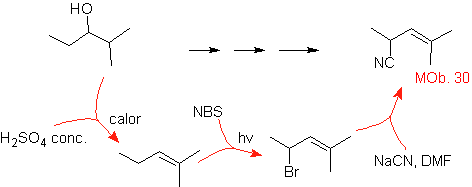
Solución
MOb 31.
Estrategia:
Se trata de un tío éter, la molécula precursora necesaria será un haluro del
1,3-ciclopentadieno.
Este haluro se prepara por la acción del NBS, sobre
el cicloalqueno dienico, el cual a su vez es preparado por la deshidrobromación
de la molécula precursora, al que se llega por la acción del NBS sobre el
cicloalqueno formado previamente por
deshidrohalogenación de la molécula de partida bromada por radicales
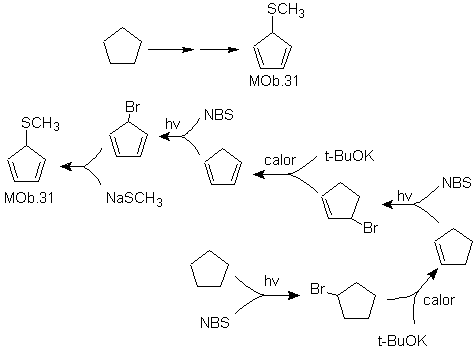
Solución
MOb 32.
Estrategia:
Es similar a la utilizada en la obtención de
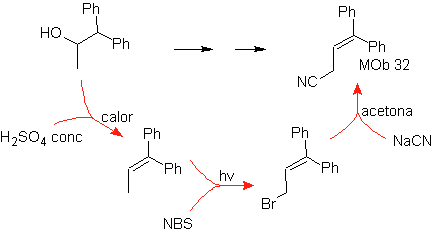
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 54821
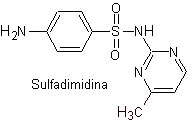
SÍNTESIS DE SULFAMIDAS
Se conoce que las sulfonamidas fueron los primeros antimicrobianos en ser utilizados en forma
sistémica. Su estructura química es un núcleo de benceno con grupos amino que
le brindan su actividad. El grupo amino es acetilado en el hígado inactivándolo.
Según el sustituyente en dicho sector el fármaco es más activo.
Dada
su semejanza con el ácido para-aminobenzoico se comporta como inhibidor
competitivo de esta sustancia que es necesaria junto a la dihidropteridina para
sintetizar el ácido dihidrofólico compuesto intermediario de la vía de síntesis
de los folatos.
Las
bacterias a diferencia de organismos más avanzados requieren sintetizar sus
propios folatos [no lo adquieren del ambiente], entonces las sulfonamidas al
inhibir este proceso inhiben los procesos de síntesis de ácidos nucléicos y son
BACTERIOSTÁTICOS.
|
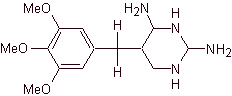
TRIMETROPRIM
El Trimetroprim es un derivado de la 2,4
diaminopirimidinas tal como |
Este compuesto INHIBE a la enzima dihidrofolato reductasa e
impide que se forme el ácido tetrahidrofólico, es decir actúan en la misma
vía metabólica que las sulfonamidas, pero en una reacción enzimática
posterior.
El trimetroprim nunca se utiliza solo, mas cuando se asocia a
sulfonamidas se potencian de tal forma que se hacen BACTERICIDAS, disminuyen
la posibilidad de generar resistencia y aumentan el espectro antimicrobiano.
La asociación entre sulfametoxazol y trimetroprim es fija: 1:5
. Por ejemplo las preparaciones comerciales Cotrimoxazol [forte o no] vienen
con esta razón. |
Las sulfamidas, generalmente se clasifican según la duración
de su acción y la forma de cómo se aplica el medicamento, así como otras
características. Según el modo de acción, las sulfamidas pueden ser:
a)
Sulfamidas
de acción corta o intermedia.
a. Sulfamidas
de uso general
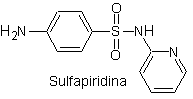
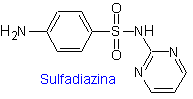
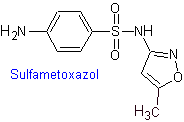
i. Sulfatiazol
ii. Sulfadiazina
iii. Sulfadimidina
iv. Sulfametoxazol (sola
o asociada a trimetoprima: cotrimoxazol)
b. Compuestos
altamente solubles empleados inicialmente en el tratamiento de las infecciones
urinarias.
i. Sulfisoxazol
ii. Sulfametizol
iii. Sulfasomidina
b)
Sulfamidas
de acción prolongada.
iv.
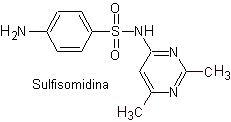
Sulfametoxipiridazina
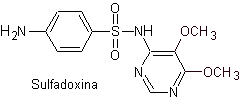
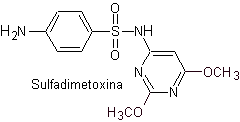
v. Sulfadimetoxina
vi. Sulfadoxina
c)
Sulfamidas
limitadas al tracto gastrointestinal
vii. Sulfaguanidina
viii. Sulfatalidina
ix. Sulfasuxidina
x. Sulfazolazina
d) Sulfamidas
tópicas.
xi. Acetato de mafenida
xii. Sulfadiazina argéntica
xiii. Sulfacetamida
de sodio
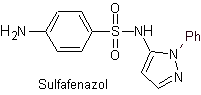
Principales sulfas:
|
|
……… |
|
|
|
|
|
|
|
…….. |
|
|
|
|
|
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 26575
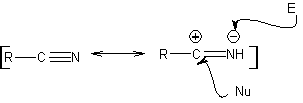
Estas reacciones normalmente forman anillos heterocíclicos de cinco eslabones, para lo cual es necesario la reacción entre un compueston1,3 dipolar y un alqueno. La reacción es una cicloadición [3-2]. Los compuestos 1,3-dipolares que más uso han tenido para formar heterociclos pentagonales son:
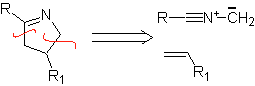 |
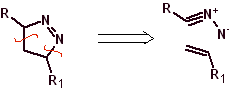 |
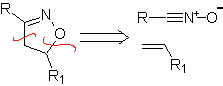 |
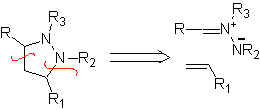 |
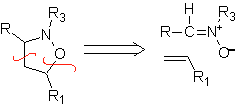 |
 |
| MOb: 86
|
. |
MOb: 87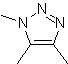 |
.. |
MOb: 88 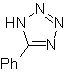 |
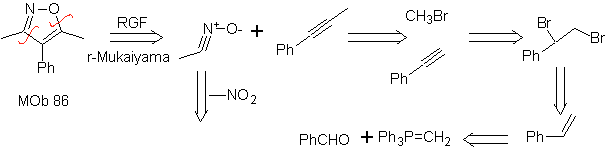
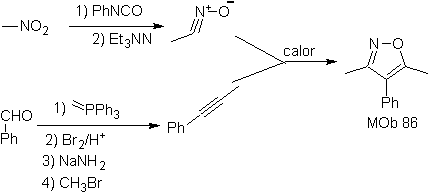
Leer más: Síntesis de heterociclos por ciclación intermolecular
- Detalles
- Wilbertrivera
- SÍNTESIS ORGÁNICA
- Visto: 28052
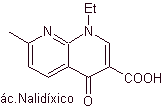
Síntesis de Antibióticos Fluoroquinolonas
Las Quinolonas pertenecen a un grupo de agentes antibacterianos
sintéticos. El agente más antiguo de esta familia, el ácido nalidíxico,
utilizada a principios de los años 60, presenta un buen espectro contra las
enterobacterias (espectro antibacteriano limitado) pero su farmacocinética no
es muy favorable para el uso rutinario en la clínica por su baja
biodisponibilidad en tejidos y su vida media corta.
Por esta razón fue necesario sintetizar nuevos antibacterianos de esta
familia para mejorar el espectro de actividad, el perfil farmacocinético,
disminuir los efectos adversos y la aparición de resistencia bacteriana. Este
nuevo grupo son las llamadas fluoroquinolonas, generadas durante la década de
los 80.
|
|
Muchos investigadores
coinciden en que la reacción de
Gould-Jacobs[1],
es la base principal de la síntesis de las primeras quinolonas de uso
farmacológico, ocurrida en la década de los años sesenta, esta reacción,
presenta la siguiente secuencia:
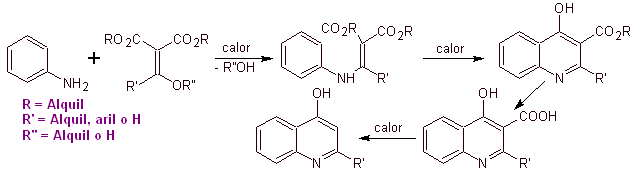
En los años
siguientes, se han introducido en el anillo básico de las benzoquinolonas, el
flúor en la posición 6 y diversos grupos de heterociclos en la posición 7, para
dar lugar a las fluoroquinolonas de mayor espectro antibacteriano.
Partes importantes de
las metodologías utilizadas en estas síntesis han sido recopiladas por Leyva S
y Leyva E[2] en un
trabajo muy bueno desde la perspectiva bioquímica.
El método de las
desconexiones aplicado al reporte de las síntesis que se estudian y las
reacciones de las primeras etapas de las síntesis son de entera responsabilidad
del autor de esta monografía[3].
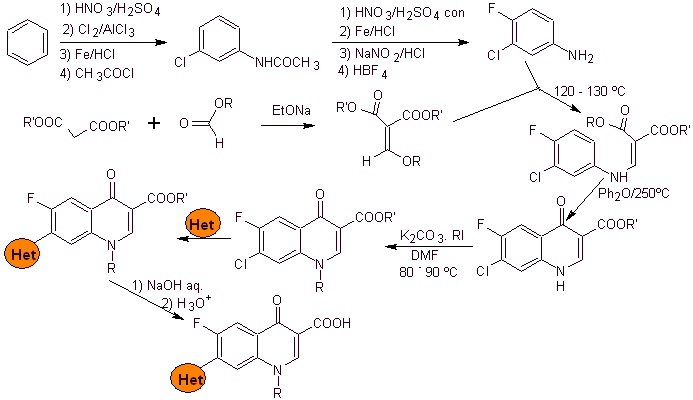
i) Síntesis reportada por Koga H. et al.[4]
Análisis
retrosintético:
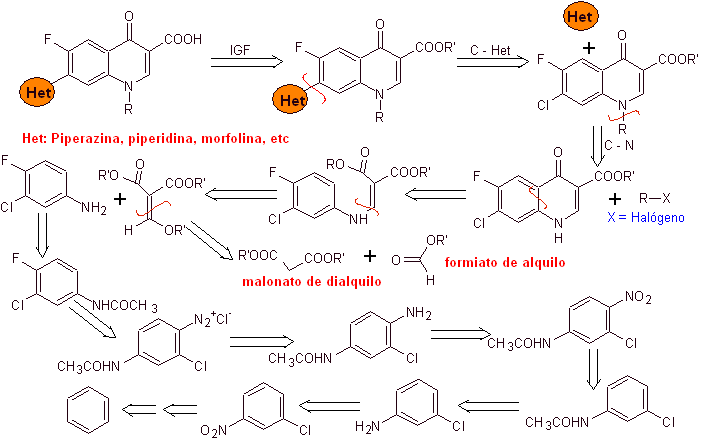
Síntesis:
Se parte del
benceno para formar la 3-cloro-4-fluoroanilina, que reacciona con el EMME de
dietilo para producir el acrilato correspondiente, que por calentamiento, forma
un compuesto cíclico. Este compuesto a su vez se hace reaccionar con un agente
alquilante y posteriormente se introduce el compuesto heterocíclico
nitrogenado, para finalmente hidrolizar y obtener la molécula objetivo.