Para que uma molécula absorva radiação infravermelha, duas condições devem ser atendidas:
- A frequência da radiação (fóton) deve ser adequada para permitir a transição entre os estados vibracionais. Em outras palavras, a frequência da radiação deve coincidir com a frequência natural do movimento vibratório.
- Uma molécula só absorve a radiação infravermelha quando seu momento de dipolo interage com o campo elétrico da onda, variando de fase com ela. Como é lógico, esse acoplamento só é possível se as frequências da radiação e da vibração do link coincidirem. Por esta razão, moléculas apolares não absorvem no infravermelho e moléculas menos polares dão origem a absorções muito fracas.
- Regra de seleção da espectroscopia de infravermelho: "somente aquelas ligações cuja vibração causa uma mudança no momento de dipolo da molécula absorvem no infravermelho".
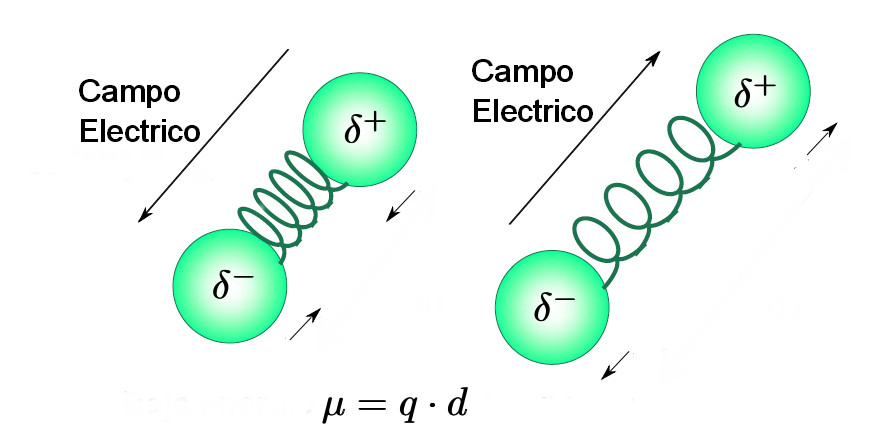
- Além disso, quanto maior a variação do momento de dipolo durante a vibração, mais intensa será a banda de absorção no espectro. Vibrações de ligações C=O, OH, NH dão origem a bandas intensas e vibrações de tensão de ligação tripla não são observáveis em alcinos simétricos ou alcenos trans com cadeias iguais.









