-
sinconocimiento
-
 Autor del tema Autor del tema
-
Fuera de línea
-
Navegador Dorado
-
-
Mensajes: 201
-
Gracias recibidas: 1
-
-
|
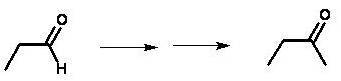
Escriba los mecanismos de reacción de una síntesis exitosa para convertir el siguiente aldehído en cetona.
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación.
|
-
janer_q
-

-
Fuera de línea
-
Navegador Dorado
-
-
Mensajes: 200
-
Gracias recibidas: 2
-
-
|
hacer reaccionar el propanal con un haluro de metilmagnesio (reactivo de Grindard). el grupo alquilo se adiciona al atomo de C carbonilico y despues de hidrolisis se forma el alcohol secundario 2-butanol. este alcohol se transforma en 2-butanona por oxidacion con KMnO4 o Na2Cr2O7/H2SO4.
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación.
|
-
pregunton
-

-
Fuera de línea
-
Navegador Dorado
-
-
Mensajes: 169
-
Gracias recibidas: 1
-
-
|
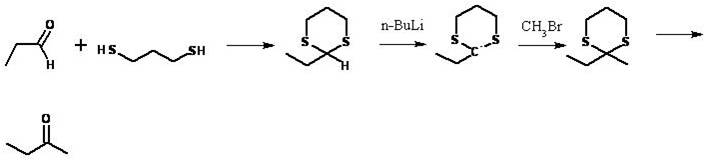
Te propongo esta síntesis dile a Germán que te coloque los demás reactivos y que te haga el mecanismo de reacción.
Pregúntale a Wilbert por qué esta síntesis es mejor que la de Janer.
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación.
|
-
janer_q
-

-
Fuera de línea
-
Navegador Dorado
-
-
Mensajes: 200
-
Gracias recibidas: 2
-
-
|
la segunda sintesis es mas larga y se nesecitan mas reactivos y etapas. creo que la propuesta por mi es mas sencilla y facil, y por tanto mejor.
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación.
|
-
pregunton
-

-
Fuera de línea
-
Navegador Dorado
-
-
Mensajes: 169
-
Gracias recibidas: 1
-
-
|
El reactivo de Grignard puede actuar como una base por lo tanto peligran los hidrógenos ácidos esos hidrógenos de alguna manera deben protegerse. El Grignard formaría un enolato intermedio no deseable además de desactivar el Grignard puesto que forma alcanos.
Por eso este método es un poco más fino.
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación.
|
-
gabo15
-

-
Fuera de línea
-
Navegador Dorado
-
-
Mensajes: 185
-
Gracias recibidas: 33
-
-
|
Hola usuario pregunton,
por un lado coincido ampliamente con el usuario Janer, por otro te recomiendo que reveas el concepto de reactivo de Grignard. Tu ruta de síntesis emplea un compuesto con dos funciones tiol, que se usa especialmente para proteger grupos sensibles a una reacción cuando la pretendemos hacer de manera selectiva. En este caso, en el aldehído no tiene ningún grupo sensible, por lo tanto es inútil recurrir esa mecanismo. Además, otra de sus utilidades es que el hemitiol cíclico reacciona sólo en condiciones ácidas (con H+), ni con el reactivo de Gilman ni nada por el estilo.
Uno de los tantos casos en los que sirve el uso de ditioles es para convertir ciclocetohexanal a hidroxiciclohexanal con el reductor NaBH4, puesto que si no usaras la protección podría también reducirse la cetona.
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación.
|
Tiempo de carga de la página: 0.209 segundos