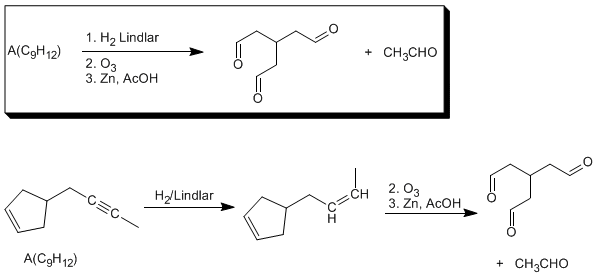
Completar la siguiente secuencia de reacciones:
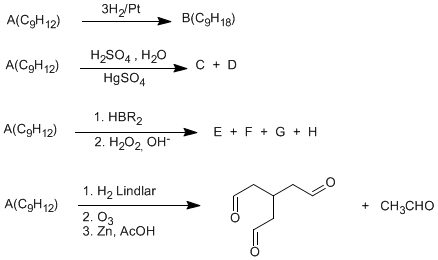
SOLUCIÓN:
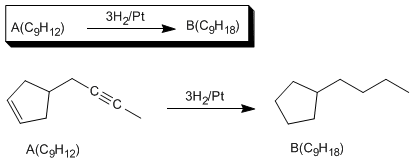
A(C9H12) tiene cuatro insaturaciones, tres hidrogenables (dobles y triples enlaces). La cuarta insaturación no hidrogenable, es un ciclo.
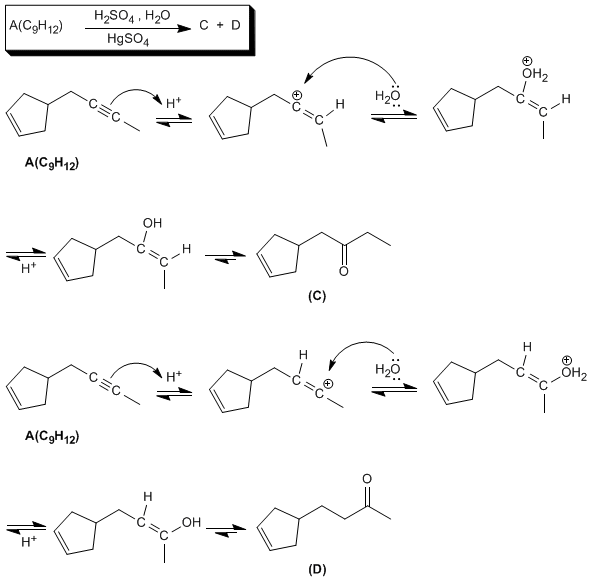
La hidratación con sulfato de mercurio y la hidrogenación con el catalizador de Lindar indican que A tiene un triple enlace (2 insaturaciones), Las otras dos insaturaciones son un doble enlace y un ciclo. La última reacción nos permite determinar la estructura del compuesto A.
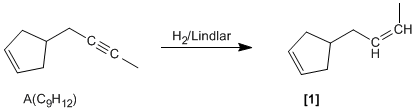
El compuesto [1] rompe con ozono dando los productos esperados. Ahora sólo falta encontrar la molécula que por reacción con H2/Lindlar da el compuesto [1]
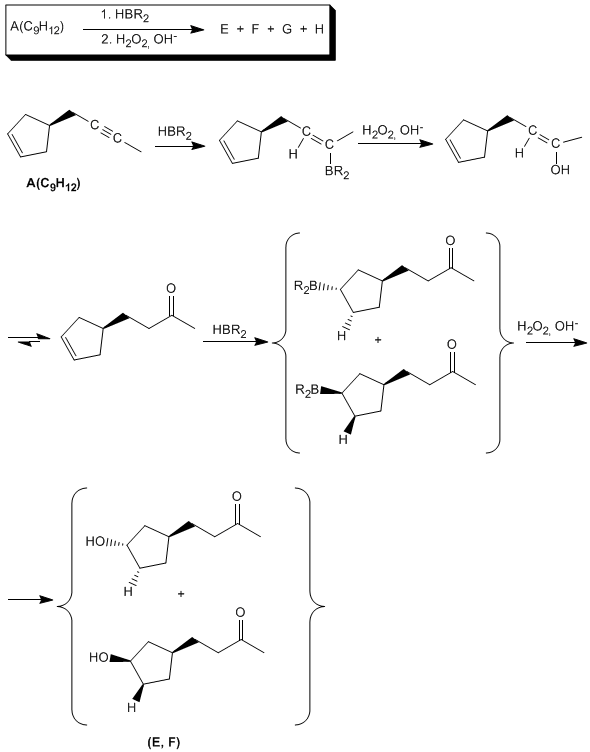
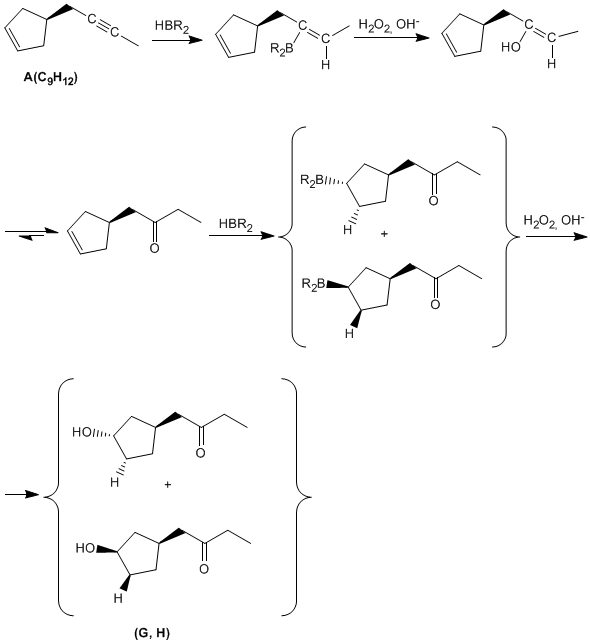
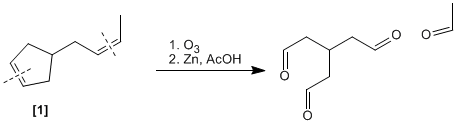
Una vez determinada la estructura del compuesto A completamos el resto de reacciones: