Las aminas presentan hidrógenos ácidos en el grupo amino. Estos hidrógenos se pueden sustraer empleando bases fuertes (organometálicos, hidruros metálicos) formando los amiduros (bases de las aminas).
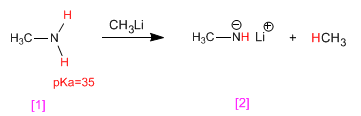
La metilamina [1 ] reacciona con metillitio, transformándose en su base conjugada, el metilamiduro de litio [2 ]. Por su parte, el metillitio se transforma en su ácido conjugado, el metano.
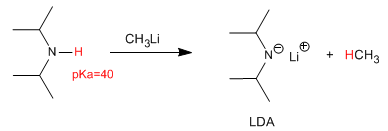
La desprotonación de la diisopropilamina produce una de las bases más utilizadas en química orgánica, el diisopropilamiduro de litio (LDA).
Sin embargo, el comportamiento más importante de las aminas es el básico. Las aminas son las sustancias orgánicas neutras de mayor basicidad.
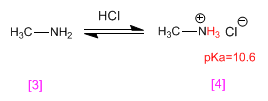
La metilamina [3 ] se protona transformándose en el cloruro de metilamonio (sal de amonio) [4 ]. Las sales de amonio son los ácidos conjugados de las aminas y tienen pKas que varían entre 9 y 11.
La basicidad de las aminas depende de los efectos inductivo y estérico. Así, el pKa sube con la longitud de la cadena carbonada (efecto inductivo)
CH3NH2 pKa=10.6
CH3CH2NH2 pKa=10.8
(CH3)3CNH2 pKa=10.4
La cadena carbonada cede carga al grupo amino, por efecto inductivo, aumentando su basicidad. La base fuerte tiene un ácido conjugado debil, por tanto el pKa sube. Pero si la cadena es muy voluminosa, comienzan a predominar efectos estéricos, que provocan una disminución del pKa.